
分析 根据导电原因、电解质、化合物的定义判断.
能导电的物质必须含有自由电子或自由离子.
电解质:在水溶液里或熔融状态下能导电的化合物.该定义的前提必须是化合物.
非电解质:在水溶液里或熔融状态下都不能导电的化合物.该定义的前提必须是化合物.
解答 解:①氯化钠晶体 是电解质,但 没有自由电子或自由离子,所以不导电.
②液态SO2,是非电解质,因没有自由电子或自由离子,所以不导电.
③液态醋酸,是电解质,因没有自由电子或自由离子,所以不导电.
④汞是单质,所以既不是电解质也不是非电解质,汞中有自由电子,所以能导电;⑤盐酸是混合物,但溶液中含有自由离子,所以能导电.
⑤BaSO4固体是电解质,因没有自由电子或自由离子,所以不导电.
⑥蔗糖是非电解质,因没有自由电子或自由离子,所以不导电.
⑦氨水是混合物,因有自由离子,所以导电.
⑧熔化的KNO3是电解质,因有自由离子,所以导电.
故答案为:④⑦⑧;①③⑤⑧;②⑥.
点评 注意以下几点错误认识:
1、能导电的物质一定是电解质,如铜不是电解质但能导电.
2、电解质一定导电,如氯化钠晶体,因没有自由电子或自由离子,所以不导电.
3、不是电解质的物质就一定是非电解质,如氯气既不是电解质也不是非电解质.
4、其水溶液能导电的化合物是电解质,如二氧化硫,二氧化硫和水反应生成亚硫酸,亚硫酸电离出自由移动的离子,所以其水溶液能导电,因离子是亚硫酸电离的而不是二氧化硫电离的,所以二氧化硫是非电解质.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| D. | 1升物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -14.2 KJ/mol | B. | -28.4 KJ/mol | C. | -42.6 KJ/mol | D. | -56.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.12g | B. | 3.51g | C. | 4.22g | D. | 5.28g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正向移动 | B. | 逆向移动 | C. | 达到平衡 | D. | 不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上合成氨的原理 | |
| B. | 工业上产生硫酸 | |
| C. | 热的纯碱溶液洗涤效果更好 | |
| D. | 受热时,试管底部的NH4Cl部分转移至试管上端 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | |
| 1.向打磨过的铝片中加入稀盐酸 | |
| 2.向打磨过的铝片中加入Na0H溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

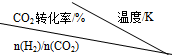 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com