
����Ŀ���Ȼ���ͭ��CuCl)�㷺Ӧ���ڻ�����ӡȾ����Ƶ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼������CuCl�Ĺ��չ������£�
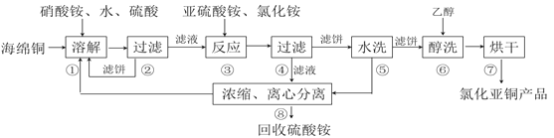
�ش��������⣺
��1���������еõ�������������_________���ܽ��¶�Ӧ������60~70�ȣ�ԭ����__________��
��2��д������������Ҫ��Ӧ�����ӷ���ʽ___________��
��3��������������pH=2����ϴ��ˮϴ������������ϴ���õ�����_________��д���ƣ���
��4�����������У�����������ʡ�ԣ�������______________________________��
��5����������������������Ҫ���й�Һ���롣��ҵ�ϳ��õĹ�Һ�����豸��__________������ĸ��
A�������� | B�����Ļ� | C����Ӧ�� | D����ʽѹ�˻� |
��6��ȷ��ȡ���Ʊ����Ȼ���ͭ��Ʒm g����������������FeCl3��Һ�У�����Ʒ��ȫ�ܽ��������ϡ���ᣬ��a mol/L��K2Cr2O7��Һ�ζ����յ㣬����K2Cr2O7��Һb mL����Ӧ��Cr2O72-����ԭΪCr3+����Ʒ��CuCl����������Ϊ__________��
���𰸡�CuSO4��Cu2+ �¶ȵ��ܽ��ٶ������¶ȹ�����ηֽ� 2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+ ���� ��ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ ��B��D ![]()
��������
��1������ͭ����Ҫ�ɷ���Cu��CuO���ܽ������Լ���������李�ˮ�����ᣬ��Cu������Ϊͭ���ӣ���ϡ��Һ�У������������������������û�������ԣ������Խ��ʣ����Cu2+��NH4+�����ɶ�Ӧ�������Ρ�
��2����������Ӧ����ˣ�˵����Ӧ���г�����������ó���ΪCuCl�������������淋Ļ��գ���֪���������������ӷ�ӦΪ��2Cu2++SO32-+2Cl-+H2O=2CuCl��+SO42-+2H+��
��3�������к��н϶������ӣ������ܽ�CuCl�����������ʣ�������������ԣ�������CuCl�����������ʣ�����ǿ����ֻ��ϡ������ʡ�
��4��CuCl�����ڴ���ˮ����ʪ��������ˮ����������ˮ�봼���ܣ����Դ�ϴ����ʡ�Ե�ԭ���Ǵ��ķе�ͣ��ɼӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ��������Ҳ�����ں���ĺ�ɲ��衣
��5�����ڷ�������Һ����豸��ʵ�����еĹ��˵�ԭ�������Ƶġ�A�������������ڷ��뻥�ܵ�Һ����豸������B�����Ļ�������������������ʹҺ���еĹ���������ﵽ��Һ�����Ŀ�ģ���ȷ��C����Ӧ��Ϊ������Ӧ���豸������D����ʽѹ�˻�����ʹ�����е�ˮͨ����ѹ���ų����ﵽ��Һ�����Ŀ�ģ���ȷ����ѡBD��
��6���������⣬CuCl��K2Cr2O7����������ԭ��Ӧ��K2Cr2O7����ԭΪCr3+����bmL��a mol/L K2Cr2O7��Һ������Ӧʱ��ת�Ƶ��ӵ����ʵ�����ab��10-3��2��3mol=6ab��10-3mol��+1��Cu�ᱻ����ΪCu2+�����ݵ�ʧ�����غ㣬��CuCl�����ʵ�����6ab��10-3mol������Ʒ��CuCl������������(6ab��10-3mol��99.5g/mol)/mg��100%=0.597ab/m��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ����Ϊ�ɼ��Ķ��Ѻ��¼����γɹ��̡���ѧ���ļ������γɻ�ѧ��ʱ�ͷŵ���������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ��mol��1)��P��P��198P��O��360O=O��498����ӦP4(����)��3O2=P4O6�ķ�Ӧ�Ȧ�HΪ ( )

A. ��1638 kJ��mol��1B. ��1638 kJ��mol��1C. ��126 kJ��mol��1D. ��126 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾʽ������ǣ�������
A.Mg2+�ĵ����Ų�ͼ��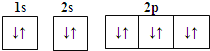
B.Na+�Ľṹʾ��ͼ��![]()
C.Cr�ļ۲�����Ų�ʽ��3d54s1
D.C�ĵ����Ų�ʽ��1s22s12p3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���224LHCl�����ܽ���635mLˮ�У�����������ܶ�Ϊ��1.18gcm��3���Լ��㣺
(1)����������������������ʵ���Ũ���Ƕ��٣�___��___
(2)ȡ����������100mL��ϡ����1.18L��������ϡ��������ʵ���Ũ�ȡ�___
(3)����������Na2CO3��NaOH��Ʒ2.53g������50.0mL2.00molL��1�������У���ַ�Ӧ�����ɱ�״���¶�����̼����112mL����Һ���ԣ��кͶ����������ȥ40.0mL1.00molL��1��NaOH��Һ�������кͺ����Һ�����յõ����ٿ˹��壿___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�ں����е�ת�ƺ��ޣ��ǵ������ѧ�о���ǰ������
��1�����ں�ˮ��CO2��Ҫ��4����̼��ʽ���ڣ�����HCO3-ռ95%��д��CO2����ˮ����HCO3-�ķ���ʽ��_____________��
��2���ں���ѭ���У�ͨ����ͼ��ʾ��;����̼��

��д���ƻ����õ����ӷ���ʽ��_____________��
��ͬλ��ʾ�ٷ�֤ʵ��������ͷų���O2ֻ������H2O����18O������ʵĹ�����õĻ�ѧ����ʽ���£����䲹��������_____________+_____________����CH2O��x+x18O2+xH2O��_____________
��3����ˮ���ܽ���̼ռ��ˮ��̼��95%���ϣ���ȷ�������о�����̼ѭ���Ļ����������ܽ���̼���ɲ������·�����
�����ᡢ����CO2����N2���ữ��ĺ�ˮ�д���CO2���ü�Һ���գ�װ��ʾ��ͼ��ͼ��ʾ���������߿��е�װ�ò�����������������Լ���_____________

�ڵζ���������Һϴ�����̼ת��ΪNaHCO3������xmol/LHCl��Һ�ζ�������ymLHCl��Һ����ˮ���ܽ���̼��Ũ��=_____________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3COONa��Һ����������������ʹˮ��ƽ�������ƶ�������pH������ (����)
A. ����������CH3COOH
B. ��������NaCl����
C. ��������NaOH����
D. ��ˮϡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ں����ܱ������з�����Ӧ2HI(g)+Cl2(g)![]() 2HCl(g) + I2(s)��������ʵ����˵���÷�Ӧ��ƽ��״̬���ǣ� ��
2HCl(g) + I2(s)��������ʵ����˵���÷�Ӧ��ƽ��״̬���ǣ� ��
A. ����1 mol Cl-Cl��ͬʱ�γ�1 mol H-Cl�� B. �����������ܶȲ��ٸı�
C. ����������ѹǿ���ٸı� D. ������������ɫ���ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)��B(g) ![]() 2C(g)��3D(g)�����ֲ�ͬ����µķ�Ӧ�������£����б�ʾ
2C(g)��3D(g)�����ֲ�ͬ����µķ�Ӧ�������£����б�ʾ
��Ӧ����������
A. v(A)��0.20mol��L��1��min��1 B. v(B)��0.30 mol��L��1��min��1
C. v(C)��0.40 mol��L��1��min��1 D. v(D)��0.50 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��6��5����������ʾ����������ȡ����ǰ�ж�����ȷ���ԿƼ�ҵ�;�������ؼ���ս���Կ��Pϡ����Ӧ���ݡ��ҹ�ϡ�������������һ���Է�̼�����Ҫ��CeFCO3����������ϡ����LnFCO3����ϡ��Ԫ��Fe��Al��Mg��SiO2�ȣ�Ϊԭ���Ʊ�CeO2��һ�ֹ���������ͼ��ʾ��

��1�����������ա�ǰ�轫��ʯ�����ϸ��������Ŀ����_________________________________�����������ա�ʱ��CeFCO3������ϡ����LnFCO3�ֱ�ת��ΪCeO2��Ln2O3����д�����ɵ�CeO2��ѧ����ʽΪ��________________________��
��2�����Ȼ������̵�Ŀ���ǽ�CeO2��Ln2O3�ֱ�ת��Ϊ�����Ե�CeCl3��LnCl3����ȥFe2O3��Al2O3��MgO��SiO2�����ʡ�����Һ��c(Ce3+)=0.01mol/L��Ϊȷ��������Ce(OH)3����������Һ��pH________����pH�ķ�Χ��������֪Ksp[Ce(OH)3=1.0��10-20]��
��3��CeO2��Ln2O3������м���ϡ���ᣬLn2O3�ܽ�����LnOCl�Ļ�ѧ����ʽΪ��___________________________________________________��
��4����������������ѡ��
�١��Ȼ���������ѡ��
���������պ��̼�����Ȼ�藺�1:3��1:4��1:5��1:6��1:7�����Ȼ�ϣ���325������ձ���60min��ϡ����������ת����ϡ���Ȼ�����Ȼ�����ͼ��ʾ��

�������պ��̼�����Ȼ�淋����������Ϊ________��
�ڡ�������������ѡ��
���������У���Ӧ�¶ȡ���Ӧʱ��Ի��ϡ���Ȼ��������ʵĹ�ϵ��ͼ��ʾ��

����¶Ⱥ�ʱ����_________��ԭ����_________________________________________��
��5��ȡ���������еõ���CeO2��Ʒ0.4500g���������ܽ����0.1000molL-1FeSO4����Һ�ζ����յ�ʱ���汻��ԭΪCe3+���������ʾ�����Ӧ��������25.00mL����Һ���ò�Ʒ��CeO2����������Ϊ___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com