
| A. | 用湿润的pH试纸测稀碱液的,测定值偏小 | |
| B. | 用量筒量取10mLNaOH 溶液时,俯视刻度.量出的体积大于10mL | |
| C. | 使用天平称量时不小心将药品与砝码的位置放反了,称最结果可能是准确的 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
分析 A.用湿润的pH试纸测稀碱液的pH,碱溶液被稀释,测定结果偏小;
B.俯视量筒的刻度线,量取的氢氧化钠溶液体积偏小;
C.若不使用游码,砝码和物品颠倒不影响称量结果;
D.将碱缓慢倒入酸中,导致部分热量散失,测定温度偏低.
解答 解:A.pH试纸被湿润后,相当于将碱溶液稀释,导致碱溶液的浓度偏小,测定结果偏低,故A正确;
B.用量筒量取10mLNaOH 溶液时,若俯视刻度,量取的溶液体积偏小,即量出的体积小于10mL,故B错误;
C.使用天平称量时不小心将药品与砝码的位置放反了,若不使用游码,对称量结果没有影响,故C正确;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,会导致热量损失,导致所测溶液温度值偏小,故D正确;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及pH试纸使用、中和滴定、量筒、托盘天平的使用方法等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
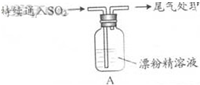 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水过程中不涉及化学变化 | B. | 金属与盐溶液反应都是置换反应 | ||
| C. | 化合反应一定有单质参加反应 | D. | 石油分馏和碘的升华都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
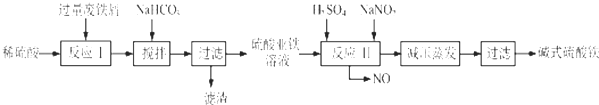
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com