
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| C. | 升高温度,正、逆反应速率都加快,反应放出的热量不变 | |
| D. | 改变压强,平衡不发生移动,反应放出的热量不变 |
分析 A.催化剂改变反应途径,但焓变不变;
B.升高温度,正逆反应速率都增大;
C.升高温度,正逆反应速率都加快,且该反应向逆反应方向移动;
D.该反应前后气体体积不变,压强不影响平衡移动.
解答 解:A.催化剂改变反应途径,但反应物和生成物能量不变导致该反应的焓变不变,故A错误;
B.升高温度,增大活化分子百分数,所以正逆反应速率都增大,故B错误;
C.升高温度,增大活化分子百分数,所以正逆反应速率都增大,该反应的正反应是放热反应,所以升高温度该反应向逆反应方向移动,放出的热量减小,故C错误;
D.该反应前后气体体积不变,压强不影响平衡移动,所以改变压强,平衡不发生移动,反应放出的热量不变,故D正确;
故选D.
点评 本题考查化学反应速率及化学平衡影响因素,为高频考点,明确化学反应特点及外界条件对反应速率、化学平衡影响原理是解本题关键,易错选项是A,题目难度不大.


科目:高中化学 来源: 题型:解答题
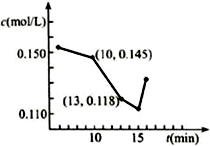
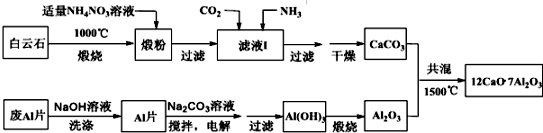
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
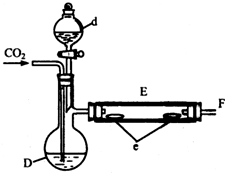
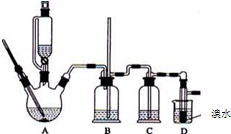 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 氧化性强弱 |
| ①取一定量FeBr2溶于水,加入少量(或几滴)氯水(或通入少量氯气),加入KSCN溶液 | 溶液呈血红色 | ②Cl2>Fe3+ Br2>Fe3+ |
| ③取少量FeBr2溶于水,加入过量氯水(或通入足量氯气),加入四氯化碳,震荡 | ④四氯化碳层呈棕红色 | Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com