
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,与硝酸反应生成Cu(NO3)2、NO和NO2,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,结合N元素守恒、电子守恒计算;若将生成的气体与一定量O2混合后通入水中被完全吸收,最终氮变成+5价,实质相当铜给电子直接给氧气,根据得失电子守恒分析解答.
解答 解:n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,由N原子守恒可知,原子守恒得生成硝酸铜需要的n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.3mol=0.6mol,气体为氮氧化物,气体的物质的量=n(NO)+n(NO2)=0.5mol,根据N元素守恒可知共消耗硝酸的物质的量为0.6mol+0.5mol=1.1mol,n(O2)
=$\frac{1}{2}$n(Cu)=0.3mol×$\frac{1}{2}$=0.15mol,所以需标准状况下O2的体积为:0.15mol×22.4L/mol=3.36L,故答案为:1.1mol;3.36.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在水溶液中的电离方程式:NaHSO4═Na++HSO4- | |
| B. | H2SO3的电离方程式:H2SO3?2H++SO32- | |
| C. | CaCO3的电离方程式:CaCO3═Ca2++CO32- | |
| D. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤⑥ | C. | ②④⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Fe3+ | C. | Fe2+、NH4+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2 | |
| B. | 由CO2+Ca(ClO)2+H2O═CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O═CaSO3↓+2HClO | |
| C. | 铝和硫直接化合能得到Al2S3,推测:铁和硫直接化合也能得到 Fe2S3 | |
| D. | 由Na2CO3+2HCl═2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl═2NaCl+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 它的系统名称是2,4-二甲基-4-戊烯 | |
| B. | 它的分子中最多有5个碳原子在同一平面上 | |
| C. | 它与甲基环己烷互为同分异构体 | |
| D. | 有机物的一氯取代产物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间所发生的碰撞都为有效碰撞 | |
| B. | 合成氨工业中用铁触媒做催化剂能用勒夏特列原理解释 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数 | |
| D. | 将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
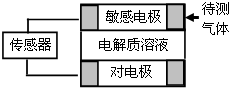 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| SO2 | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测分别含SO2和CO体积分数相同的两份体积相同的空气样本时,传感器上产生的电流大小相同 | |
| C. | 检测CO时,敏感电极上的电极反应式为CO+2OH--2e-═CO2+H2O | |
| D. | 检测NO2时,电解质溶液可选NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com