
| A. | 常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA | |
| B. | 常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 | |
| C. | 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA | |
| D. | 在含有4molSi-O键的石英晶体中,氧原子的数目为4 NA |
分析 A、pH=1的硫酸溶液中氢离子浓度为0.1mol/L;
B、C2H4和C3H6的最简式均为CH2;
C、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
D、1mol二氧化硅中含4mol硅氧键.
解答 解:A、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,故1L溶液中含有的氢离子的物质的量为0.1mol,个数为0.1NA个,故A正确;
B、C2H4和C3H6的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,故含2NA个氢原子,故B正确;
C、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠转移0.1NA个电子,故C正确;
D、1mol二氧化硅中含4mol硅氧键,故含4mol硅氧键的二氧化硅的物质的量为1mol,故含2NA个氧原子,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | 若将两种酸溶液等体积混合,混合溶液的pH一定等于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 植物油不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体、碳酸钠、冰与水的混合物 | B. | 酒精、浓硫酸、硫酸铜 | ||
| C. | 金刚石、铁矿石、大理石 | D. | 水银、水蒸气、水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2中阴阳离子的个数比为1:1 | |
| B. | Na2O2投入到酚酞溶液中,溶液变红 | |
| C. | Na2O2投与FeCl2溶液的反应:能将Fe2+氧化成Fe3+,得到Fe(OH)3沉淀 | |
| D. | Na2O2与水反应,Na2O2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,当剩余少量水时用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球与蒸馏烧瓶的支管口相平 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
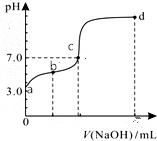 常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )
常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )| A. | 由题可知HA为弱酸 | |
| B. | 滴定终点位于c和d点之间 | |
| C. | 滴定到b点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol | |
| D. | 滴定到d点时:c(OH-)>c(Na+)>c(A-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com