
【题目】根据反应Br+H2![]() HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
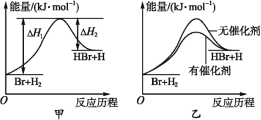
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】下图所示在不同条件下的酶促反应速率变化曲线。据图分析叙述错误的是( )

A. 影响AB段反应速率的主要因素是底物浓度
B. 影响BC段反应速率的主要限制因素可能是酶量
C. 温度导致了曲线Ⅰ和Ⅱ的反应速率不同
D. 曲线Ⅰ显示,该酶促反应的最适温度为37 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是中学化学常见的单质,Y、Z为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是
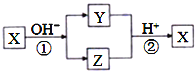
A. X可能是金属,也可能是非金属
B. X、Y、Z含有一种相同的元素
C. Y、Z的水溶液一定都呈碱性
D. 反应①②不一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质:
①金刚石与石墨;②D 与T;③12C和13C;④O2与O3;⑤CH4和CH3CH2CH3 ⑥![]() 和CH3(CH2) 3CH3⑦
和CH3(CH2) 3CH3⑦ 和
和 ⑧
⑧![]() 和
和![]()
其中属于同素异形体的是______![]() 填序号,下同
填序号,下同![]() ;属于同位素的是______;属于同系物的是______;属于同分异构体的是______;属于同种物质的是的是______。
;属于同位素的是______;属于同系物的是______;属于同分异构体的是______;属于同种物质的是的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中a/b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________(填字母)。
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
Ⅱ.某研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:

实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是___________________(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?_____(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a.若不正确,请说明原因。
b.若正确,则写出实验③中原电池的正、负极电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g ) ΔH1=-178 kJ/mol
②2CO(g)+O2(g)2CO2(g) ΔH2=-566 kJ/mol
③2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ/mol
已知反应①中相关的化学键键能数据如下:
化学键 | C—C | C—H | H—H | C—O | H—O |
键能/ kJ/mol | 348 | 413 | 436 | 358 | 463 |
由此计算断开1 mol C![]() O需要吸收____________kJ的能量(甲醇的球棍模型如图所示
O需要吸收____________kJ的能量(甲醇的球棍模型如图所示 );
);
CO(g)+2H2(g)CH3OH(g) ΔH=________ kJ/mol。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如下图所示:通入a气体的电极是原电池的______极(填“正”或“负”),其电极反应式为___________________。

(3)下图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是______(填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____mol,消耗标准状况下CH4________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1 L 1.0 mol·L-1的氢氧化钠溶液吸收0.8 mol二氧化碳,所得溶液中碳酸根离子与碳酸氢根离子的物质的量浓度之比是 ( )
A.1∶3
B.1∶2
C.2∶3
D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A和芳香烃D为原料合成化合物X的路线如图所示:

回答下列问题:
(1)A的名称是_______,F中含有的官能团名称是__________。
(2)E生成F的反应类型是___________。
(3)反应D→E的化学方程式为_______________________________。
(4)反应F→H的化学方程式为_________________________________。
(5)X的结构简式为________________,下列有关X的说法正确的是________(填字母)。
a.能发生水解反应 b.能发生银镜反应
c.不能使溴的四氯化碳溶液褪色 d.能与浓硝酸发生取代反应
(6)芳香族化合物M是G的同分异构体,M能与NaHCO3溶液反应产生气体,符合条件的M有_____种,其中核磁共振氢谱有6组峰且峰面积之比为1:2:2:2:2:1的是____________(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com