
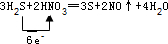 ,
,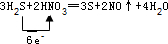 ;
;| 3.36L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LN2含阿伏加德罗常数个氮分子 |
| B、在标准状况下,22.4L水的质量约为18g |
| C、22g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| H2SO4 |
| CuO |
| H2SO4 |
| Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H=-Q1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 | ||||
| B、S(s)+O2(g)=SO2(g)△H=-Q1 S(g)+O2(g)=SO2(g)△H=-Q2 | ||||
C、C(s)+O2(g)=CO2(g)△H=-Q1 C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g)△H=-Q1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=x(3-0.5m) |
| B、m=n+2x |
| C、m=n-6,m、n均与x无关 |
| D、n=m,m、n均与x无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S |
| B、用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜、镁的金属活动性强弱 |
| C、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 |
| D、测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、硝酸钾 |
| C、氯化钡 | D、氯化铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com