
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
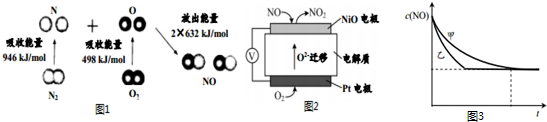
分析 (1)N2(g)+O2(g)=2NO(g),根据能量变化图计算反应热,反应热=反应物断键吸收的能量-生成物形成释放出的能量;
(2)根据图知有外接电源,这是一个电解装置,用O2-的运动方向判断出NiO电极是阳极,阳极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应,铂电极是阴极,氧气得到电子,发生还原反应,据此解答;
(3)①验证温度对化学反应速率的影响,温度要不同,其他条件相同;验证催化剂的比表面积对化学反应速率的影响,要催化剂的比表面积不同,其他条件相同;
②验证温度对化学反应速率的影响,只有实验Ⅰ和Ⅲ的温度不同,其他条件要相同;
③催化积的比表面积大,反应速率快,达平衡的时间短.
解答 解:(1)N2(g)+O2(g)=2NO(g),反应热=反应物断键吸收的能量-生成物形成释放出的能量,该反应的反应热=(946+498)kJ/mol-2×632kJ/mol=+180kJ/mol,
所以这是一个吸热反应,1molN2和1molO2完全反应生成NO会吸收180kJ的能量,
故答案为:吸收;180;
(2)根据图知有外接电源,这是一个电解装置,用O2-的运动方向判断出NiO电极是阳极,阳极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应,铂电极是阴极,氧气得到电子,发生还原反应,
①NiO电极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应,
故答案为:氧化;
②在外电路中,电子从阳极(NiO)经外电路到阴极(pt),
故答案为:NiO;pt;
③pt电极上是氧气得到电子被还原成氧离子,离子方程式为:O2+4e-=2O2-,
故答案为:O2+4e-=2O2-;
(3)①验证温度对化学反应速率的影响,温度要不同,其他条件相同,所以a=1.2×10-3;验证催化剂的比表面积对化学反应速率的影响,要催化剂的比表面积不同,其他条件相同,b=5.80×10-3,
故答案为:1.2×10-3;5.80×10-3;
②验证温度对化学反应速率的影响,只有实验Ⅰ和Ⅲ的温度不同,其他条件要相同,
故答案为:Ⅰ和Ⅲ;
③催化积的比表面积大,反应速率快,达平衡的时间短,曲线乙的斜率大,反应快,
故答案为:乙.
点评 本题考查反应热的计算、电解的工作原理,用实验探究影响化学反应速率的因素,注意控制变量的重要性,考查学生对图象的理解和分析,难度适中.


科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| B. | Z位于元素周期表中第二周期,第ⅥA族 | |
| C. | X的气态氢化物的稳定性比Z的弱 | |
| D. | M的原子半径比Y的原子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在硫酸催化下水解,只生成葡萄糖 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 1L1mol•L-1AlCl3溶液中含Al3+数目为6.02×1023 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com