
【题目】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
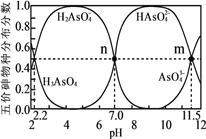
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
【答案】B
【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;
B.根据H3AsO4的电离平衡常数计算;
C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;
D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;
B.H3AsO4的Ka2=![]() ,pH=7时c(HAsO42-)=c(H2AsO4-),Ka2=c(H+)=10-7,pKa2=7,B错误;
,pH=7时c(HAsO42-)=c(H2AsO4-),Ka2=c(H+)=10-7,pKa2=7,B错误;
C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;
D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。


科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
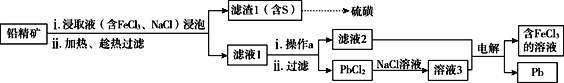
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
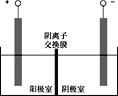
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Al3+、Fe2+、Cl-、SO42-B. NH4+、HCO3-、Cl-、K+
C. Na+、Ba2+、NO3-、SO42-D. Cl -、Na+、NO3-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是( )
A.分子直径的大小
B.分子间距离的大小
C.分子间引力的大小
D.分子数目的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele),如图甲。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenyonl),如图乙。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( )
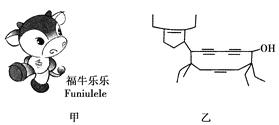
A. 牛式二烯炔醇含有三种官能团
B. 牛式二烯炔醇含有三个手性碳原子
C. 1 mol 牛式二烯炔醇最多可与6 mol Br2发生加成反应
D. 牛式二烯炔醇分子内能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.萃取操作可在普通漏斗中完成
B.浓烧碱液沾到皮肤上应立即用稀盐酸冲洗
C.闻未知液体或气体的气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动
D.用容量瓶配制好一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是一种重要的半导体材料。工业上用精硫锗矿(主要成分为GeS2,杂质不反应)制取Ge,其工艺流程如图所示:

回答下列问题:
(1)开始将精硫锗矿粉碎的目的是______。
(2)高温焙烧精硫锗矿的化学方程式为______。
(3)热还原真空挥发炉内反应的化学方程式为______。
(4)在沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为______(填“10-15”“15-20”或“20-25”),理由是______。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)某温度时,沉锗得到的CaGeO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是______。

a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点
(6)CaGeO3与强酸反应可得到H2GeO3。0.l molL-1的NaHGeO3溶液pH_____(填“>”“=”或“<”)7,判断理由是______(通过计算比较)。(25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第________周期,第________族,________区。
(2)Zn形成金属晶体,其金属原子堆积属于下列______模式。
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________;葡萄糖分子中碳原子的杂化方式为________。
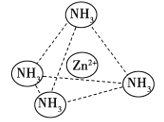
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在右下图中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键______。
(5)下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______________________。该化合物晶体的熔点比干冰高得多,原因是____________________。

(6)与锌同周期,最外层有3个未成对电子的元素名称是________,该元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示,且实验测得A室混合气体的质量为34 g。则下列说法中不正确的是( )
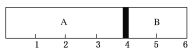
A. A室中混合气体所含分子总数为2NA
B. A室中混合气体的密度是同温同压下氢气密度的8.5倍
C. A室中混合气体中H2与O2的物质的量之比为1:1
D. 将A室H2、O2的混合气体点燃引爆,恢复到室温后,最终活塞恰好停留在3刻度处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com