
| A. | 实验室用大理石和稀盐酸制取CO2 气体 CO32-+2H+═CO2↑+H2O | |
| B. | 氧化钠和盐酸 O2-+2H+═H2O | |
| C. | 澄清石灰水和稀盐酸 OH-+H+═H2O | |
| D. | 铜和稀硫酸 Cu+2 H+═Cu2++H2↑ |
分析 A.碳酸钙为沉淀,应保留化学式;
B.氧化物应保留化学式;
C.二者反应实质氢离子与氢氧根离子反应生成水;
D.不符合反应客观事实.
解答 解:A.实验室用大理石和稀盐酸制取CO2 气体,离子方程式:Ca CO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B.氧化钠和盐酸,离子方程式:Na2O+2H+═H2O+2Na+,故B错误;
C.澄清石灰水和稀盐酸,离子方程式:OH-+H+═H2O,故C正确;
D.铜与稀硫酸不反应,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意离子反应遵循客观事实,遵循原子个数、电荷守恒规律,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
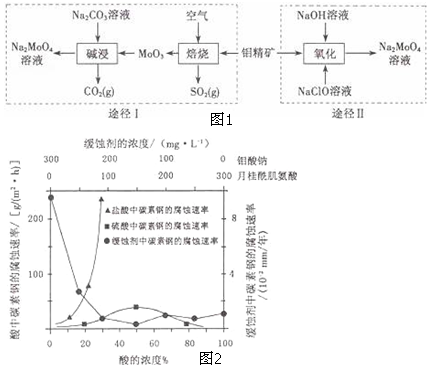
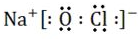 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
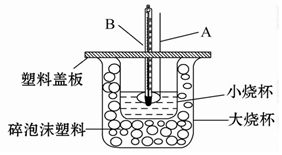
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加稀盐酸 | 有气泡产生 | 原溶液中有CO32- |
| B | 滴加盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中有Ag+或SO42- |
| C | 用洁净铂丝蘸取溶液进行灼烧 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
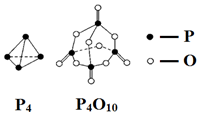
| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 食盐中添加碘酸钾(KIO3)加工碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
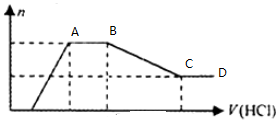
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前 5min 的平均速率为 v (SO2)=0.08mol•L-1•min-1 | |
| B. | 保持温度不变,向平衡后的容器中再充入 1molSO2和 0.5molO2时,v (正)>v (逆) | |
| C. | 该温度,反应的平衡常数为 11.25L•mol-1 | |
| D. | 相同温度下,起始时向容器中充入 1.5mol SO3,达平衡时 SO3的转化率为 40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com