考点:物质的量或浓度随时间的变化曲线,热化学方程式,原电池和电解池的工作原理,化学平衡建立的过程,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:Ⅰ.(1)CH
3OH(1)标准燃烧热△H=-726.5kJ?mol
-l,热化学方程式为:①CH
3OH(l)+
O
2(g)═CO
2(g)+2H
2O(l)△H=-726.5 kJ?mol
-1,H
2(g)燃烧生成液态水的热值为142.9KJ?g
-1,热化学方程式为:②H
2(g)+
O
2(g)=H
2O(1);△H=-285.8KJ/mol,反应CO
2(g)+3H
2(g)?CH
3OH(1)+H
2O(1)可由上述②×3-①得到,根据盖斯定律可求得△H值;
(2)A.该反应为熵减的放热反应,根据△G=△H-T△S判断;
B.根据平衡状态的特征判断;
C.该反应为放热反应,根据温度对平衡移动的影响,判断温度的变化;
D.根据催化剂是同等程度的改变正逆反应的速率作判断;
(3)①45s时达到平衡,此时CO
2的转化率为68.75%,即平衡时CO
2的浓度为0.04×(1-68.75%)mol/L=0.0125mol/L,即在20s--45s之间CO
2的浓度从0.016变化到0.0125,而在此之后直到70sCO
2的浓度都保持不变,据此作图;
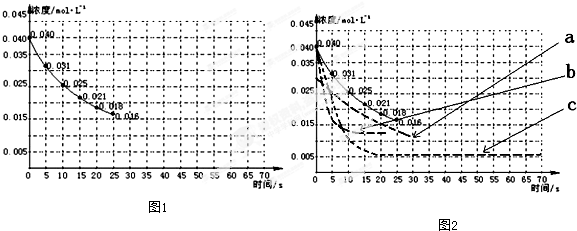
②由图2可知,比较三条曲线,a线对应的CO
2的起始浓度最小,故对应实验A,比较b线和c线可知,b线开始反应的速率比c线快,故b线对应高温、催化剂的条件,即对应实验C,则曲线c对应实验B,据此答题;
Ⅱ.(1)根据H
2CO
3的电离方程式计算电离平衡常数;根据HClO的电离平衡常数和H
2CO
3的两级电离平衡常数比较可知,HClO的酸性介于H
2CO
3和HCO
3-之间,所以少量氯水与碳酸钠反应生成碳酸氢盐,据此写离子方程式;
(2)根据溶液中离子浓度积先达到其Ksp值的物质先沉淀进行判断;
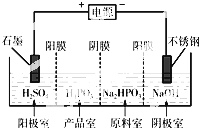
Ⅲ①阴极上得电子发生还原反应;
②产品室中HPO
32-和氢离子结合 生成亚磷酸.
解答:
解:Ⅰ.(1)CH
3OH(1)标准燃烧热△H=-726.5kJ?mol
-l,热化学方程式为:①CH
3OH(l)+
O
2(g)═CO
2(g)+2H
2O(l)△H=-725.8 kJ?mol
-1,H
2(g)燃烧生成液态水的热值为142.9KJ?g
-1,热化学方程式为:②H
2(g)+
O
2(g)=H
2O(1);△H=-285.8KJ/mol,反应CO
2(g)+3H
2(g)?CH
3OH(1)+H
2O(1)可由上述②×3-①得到,根据盖斯定律可得△H=-285.8KJ/mol×3-(-725.8 kJ?mol
-1)=-130.9kJ?mol
-1,故答案为:-130.9kJ?mol
-1;
(2)A.该反应为熵减的放热反应,根据△G=△H-T△S可知,该反应在低温下能自发进行,故A正确;
B.因为CO
2和H
2起始加入的物质的量之比为1:3,参加反应的也是1:3,所以在建立平衡的过程中,容器内CO
2气体体积分数始终不变,所以CO
2气体体积分数不能判断反应是否处于平衡状态,故B错误;
C.当平衡常数K(T
1)>K(T
2),说明在T
1时反应正向进行的程度大,由于该反应为放热反应,所以可以判断T
1<T
2,故C正确;
D.因为催化剂是同等程度的改变正逆反应的速率,所以当Y能使逆反应速率加快约8×10
6倍的同时,正反应也加快约8×10
6倍,因此选择Y为催化剂更合适,故D错误;
故选AC;
(3)①45s时达到平衡,此时CO
2的转化率为68.75%,即平衡时CO
2的浓度为0.04×(1-68.75%)mol/L=0.0125mol/L,即在20s--45s之间CO
2的浓度从0.016变化到0.0125,而在此之后直到70sCO
2的浓度都保持不变,据此可作出图为
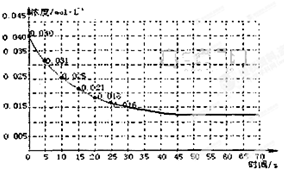
,
故答案为:

;
②由图2可知,比较三条曲线,a线对应的CO
2的起始浓度最小,故对应实验A,比较b线和c线可知,b线开始反应的速率比c线快,故b线对应高温、催化剂的条件,即对应实验C,则曲线c对应实验B,故答案为:

;
Ⅱ.(1)根据H
2CO
3的电离方程式H
2CO
3=HCO
3-+H
+可计算电离平衡常数K
a1=
=
=
=4.2×10
-7;根据HClO的电离平衡常数和H
2CO
3的两级电离平衡常数比较可知,HClO的酸性介于H
2CO
3和HCO
3-之间,所以少量氯水与碳酸钠反应生成碳酸氢盐,其离子方程式为Cl
2+2CO
32-+H
2O=2HCO
3-+Cl
-+ClO
-,
故答案为:4.2×10
-7;Cl
2+2CO
32-+H
2O=2HCO
3-+Cl
-+ClO
-;
(2)向一含有Ca
2+、Cd
2+的混合液中滴加Na
2CO
3溶液,若首先生成CdCO
3沉淀,不能说明Ksp的大小,也无法确定离子浓度大小,因为只有当溶液中离子浓度积大于其Ksp就会有沉淀出现,由此确定A、B都错误,但由于c(Cd
2+)?c(CO
32-)>Ksp(CdCO
3),c(Ca
2+)?c(CO
32-)<Ksp(CaCO
3),则
>
,即
>
,由此确定C正确,D错误,故答案为:C;
Ⅲ.①阴极上氢离子得电子发生还原反应,电极反应式为2H
++2e
-=H
2↑,故答案为:2H
++2e
-=H
2↑;
②产品室中HPO
32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO
32-+2H
+=H
3PO
3,故答案为:HPO
32-+2H
+=H
3PO
3.
点评:本题考查的知识点较多,综合性较强,难度较大,对学生的综合应用基础知识的能力要求较高.


 ,
, ;
; ;
;


 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的