
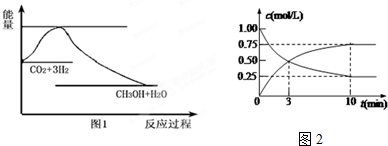
分析 (1)依据反应和图象分析判断:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0;
(2)在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式计算判断;
②依据化学反应的影响因素和条件逐项分析判断;
A、反应是放热反应,升温平衡逆向进行;
B、将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C、选择高效催化剂只能改变速率,不改变化学平衡;
D、再充入l molCO2和4molH2,增大压强平衡正向进行;
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH3OH+3O2+4KOH→2K2CO3+6H2O;正极反应为O2+2H2O+4e-=4OH-;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式.
解答 解:(1)依据反应和图象分析判断:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0,
故答案为:C;
(2)在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则
①依据化学平衡列式计算为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 4 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 1.75 0.75 0.75
CO2的平均反应速率v(CO2)=$\frac{0.75mol}{10min}$=0.075mol•L-1•min-1 ;故答案为:0.075 mol•L-1•min-1;
②措施中能使化学平衡向正反应方向移动的是:
A、反应是放热反应,升温平衡逆向进行;故A错误;
B、将CH3OH(g)及时液化抽出,减小生成物的量,平衡正向进行,故B正确;
C、选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D、再充入l molCO2和4molH2,增大压强平衡正向进行,故D正确;
故答案为:BD;
(3)25℃,1.01×105Pa时,16g 液态甲醇物质的量为0.5mol,完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH3OH+3O2+4KOH→2K2CO3+6H2O;正极反应为O2+2H2O+4e-=4OH-;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查了反应的焓变判断,热化学方程式的书写原则,电极反应和电池反应的分析书写,化学平衡的影响因素判断平衡移动方向,化学平衡的计算的应用,图象分析是关键.综合性较大,难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 能量转化形式相同 | B. | 两极的名称相同 | ||
| C. | 负极和阴极上移向的离子类别相同 | D. | 负极和阳极上发生的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请在标有序号的空白处填空:
请在标有序号的空白处填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2O<H2S<H2Se | B. | 半径:F->Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、热的纯碱溶液 | B. | 硫黄、CS2 | ||
| C. | 水垢、食醋 | D. | 石蜡、蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com