
| A. | 氮化硅陶瓷 耐高温 | B. | 氧化锆陶瓷 韧性和耐磨性 | ||
| C. | 钛酸钡陶瓷 导电性 | D. | 氧化铝陶瓷 透光性 |
 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数为0.3 NA | |
| D. | 1 mol Na2O2与足量CO2反应转移的电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加铜片和浓硫酸,加热 | 有无色气体产生,遇空气变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有不溶于稀硝酸的白色沉淀生成 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2<Q1<197 kJ•mol-1 | B. | Q2=Q1=197 kJ•mol-1 | ||
| C. | Q1<Q2<197 kJ•mol-1 | D. | Q2=Q1<197 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.
如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
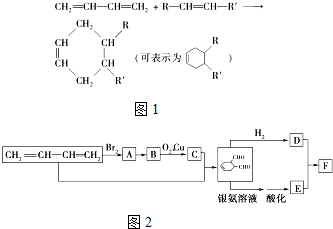
 中含氧官能团的名称是醛基
中含氧官能团的名称是醛基 OHCCH=CHCHO+2H2O.
OHCCH=CHCHO+2H2O. .
. 、HC≡CCOOCH3.
、HC≡CCOOCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
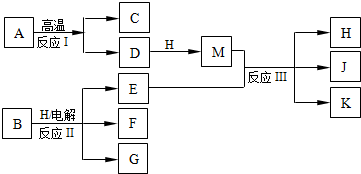
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 60 mL 1 mol/L纯碱溶液与20 mL 2 mol/L胆矾溶液混合(无气体放出):3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓ | |
| C. | 向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑ | |
| D. | 向碳酸氢钙溶液中加入少量KOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com