
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
分析 A.n(KOH)=2mol/L×0.75L=1.5mol,n(KOH):n(CO2)=1.5mol:1mol=3:2,任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.能和铝反应生成气体的溶液为酸性或碱性;
C.等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应生成碳酸钙沉淀和水;
D.Ca与O元素形成化合物中可能存在共价键.
解答 解:A.n(KOH)=2mol/L×0.75L=1.5mol,n(KOH):n(CO2)=1.5mol:1mol=3:2,任何电解质溶液中都存在物料守恒,根据物料守恒得:3(K+)=2 c(CO32-)+2c(HCO3-)+2c(H2CO3),故A错误;
B.能和铝反应生成气体的溶液为酸性或碱性,如果溶液呈酸性,则Fe2+、NO3-发生氧化还原反应而不能共存,如果呈碱性,则NH4+、Fe2+不能大量共存,故B错误;
C.等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应生成碳酸钙沉淀和水,离子方程式为CO32-+Ca2++H++OH-=CaCO3↓+H2O,故C正确;
D.Ca与O元素形成化合物中可能存在共价键,如CaO2,故D错误;
故选C.
点评 本题考查离子浓度大小比较、离子共存、离子方程式的书写、化学键等知识点,侧重考查基本理论,注意B中酸性条件下硝酸根离子和亚铁离子发生氧化还原反应,易错选项是D,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
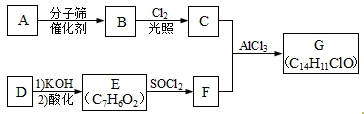
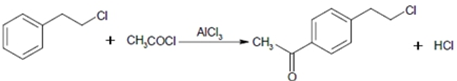
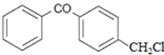 .
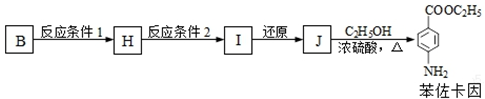
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
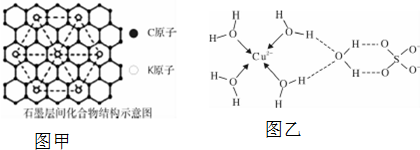
| 元素 | Mn | Fe | |
| 电离能 KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应 | |
| B. | Ba(OH)2•8H20晶体与NH4Cl晶体的反应 | |
| C. | 硫酸与氢氧化钡溶液反应 | |
| D. | 煤的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| D. | 实验室可以用浓硫酸与氯化钠固体共热制取氯化氢气体,因此浓硫酸与碘化钠固体共热也能制取碘化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com