
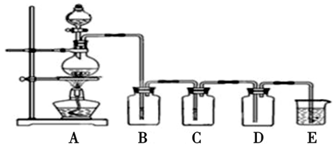
分析 (1)制备气体在添加药品前需要检查装置气密性;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水蒸气;
(3)D装置中品红溶液的作用是验证二氧化硫是否被高锰酸钾溶液完全吸收,D装置中品红不褪色,装置E澄清石灰水变浑浊说明生成二氧化碳;
(4)若证明SO2具有氧化性,通过Na2S溶液验证,同时证明碳酸的酸性比硅酸的强,是除净二氧化硫的二氧化碳气体通过硅酸钠溶液生成白色沉淀证明.
解答 解:(1)实验步骤:连接仪器、检查装置气密性、加药品后,然后滴入浓硫酸,加热,
故答案为:检查装置气密性;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水蒸气,反应的化学方程式为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,B为检验二氧化硫存在,C装置则高锰酸钾溶液是吸收二氧化硫,则D装置中品红溶液的作用是验证二氧化硫是否被高锰酸钾溶液完全吸收,证明气体中有CO2的现象是D装置中品红不退色,E装置中有白色沉淀,
故答案为:检验SO2;检验SO2是否除尽; D中品红不褪色,E中澄清石灰水变浑浊;
(4)若证明SO2具有氧化性,通过装置B中的Na2S溶液验证,二氧化硫和硫化钠反应生成硫单质,溶液中变浑浊,证明碳酸的酸性比硅酸的强,是通过高锰酸钾溶液除去二氧化硫后,再通过品红溶液检验二氧化硫是否除净,把气体通过硅酸钠溶液生成白色沉淀证明碳酸的酸性比硅酸的强,装置E中为硅酸钠溶液,B中有沉淀为S,二氧化碳和硅酸钠溶液反应生成白色沉淀硅酸,反应的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:产生淡黄色沉淀;Na2SiO3;产生白色沉淀;SiO32-+CO2+H2O=H2SiO3↓+CO32-.
点评 本题考查性质实验,侧重考查实验操作、分析能力,明确物质的性质是解本题关键,注意二氧化硫和二氧化碳都能使澄清石灰水变浑浊,注意二氧化硫不能使酸碱指示剂褪色,为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 日常生活中,卤水点豆腐、花生中提取花生油、海水晒盐都是物理变化 | |
| C. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 | |
| D. | 铝比铁活泼,所以一般情况下,铁制品比铝制品更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的PH减小 | |
| C. | 中和滴定时,滴定管用所盛装的反应液润洗2〜3次 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  验证铁的吸氧腐蚀 | B. |  测定双氧水分解速率 | ||
| C. |  蒸干MgCl2溶液制备MgCl2固体 | D. |  模拟合成氨并验证有氨气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
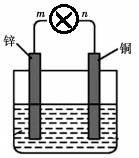 将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.
将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0 g | B. | 5.4g | C. | 6 g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁制品比钢铁制品更耐腐蚀 | |
| B. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢 | |
| C. | 钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液 | |
| D. | 铝片不用特殊方法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,降低反应的活化能,可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 电解法精炼铜时,以粗铜作阳极,粗铜中的所有金属都以离子的形式进入电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时压强是起始压强的$\frac{15}{14}$倍 | B. | 平衡时NH3的浓度为1 mol/L | ||
| C. | 该过程中v(O2)=0.225 mol/(L•min) | D. | 达平衡时消耗O2 1.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com