
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:分析 (1)该溶液物质的量浓度=$\frac{1000ρω%}{M}$;
(2)溶液密度、物质的量浓度与溶液体积无关,溶液中溶质物质的量、微粒数都与体积有关;
(3)①依据稀释前后溶液中所含溶质的物质的量不变计算所需浓硫酸的体积;由于硫酸的密度比水的大,则等体积混合时,硫酸溶液的质量大于水的质量,据此分析;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
③根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)混合溶液中c(SO42-)=$\frac{n({H}_{2}S{O}_{4})+n(Cu{SO}_{4})}{V(混合溶液)}$.
解答 解:(1)该溶液物质的量浓度=$\frac{1000ρω%}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4;
(2)A.根据n=cV知,溶质的物质的量与溶液体积有关,故A选;
B.溶液是均一稳定的,物质的量浓度与溶液体积无关,故B不选;
C.溶液是均一稳定的,溶液的密度与溶液体积无关,故C不选;
D.根据N=CVNA可知,溶液中H2SO4分子数与溶液体积有关,故D选;
故选AD;
(3)①由于实验室无420mL容量瓶,故应选择500mL容量瓶,配制出500mL溶液,设需要浓硫酸体积V,稀释前后溶液中所含溶质的物质的量不变,所以18.4mol/L×V=02.0mol•L-1×500mL,解得V=54.3ml;由于硫酸的密度比水的大,则等体积混合时,硫酸溶液的质量大于水的质量,故将此硫酸与等体积的水混合时,稀释后硫酸的质量分数大于49%.
故答案为:54.3;>;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序为:CBGFAED,故答案为:CBGFAED;
E、定容时,先直接向容量瓶中注水至液面离刻度线1-2cm,后改用胶头滴管逐滴加入至凹液面与刻度线相切,故答案为:胶头滴管;
③A.摇匀后静置,发现液面低于刻线是正常的,若继续加水至与刻线相切则会导致浓度偏低,故A错误;
B.溶液没有恢复到室温就进行定容,则冷却后溶液体积偏小,浓度偏高,故B正确;
C.量取浓硫酸时仰视读数,会导致所量取的浓硫酸的体积偏答,则所配制出的稀硫酸的浓度偏高,故C正确;
D.稀释用的烧杯和玻璃棒未洗涤,会导致溶质的损失,则浓度偏低,故D错误;
E.定容时仰视读数,则会导致溶液体积偏大,则浓度偏小,故E错误.
故选B;
(4)混合溶液中c(SO42-)=$\frac{n({H}_{2}S{O}_{4})+n(Cu{SO}_{4})}{V(混合溶液)}$=$\frac{2mol/L×0.2L+4.5mol/L×0.3L}{0.5L}$=3.5mol/L,故答案为:3.5.
点评 本题考查一定物质的量浓度溶液配制,侧重考查学生实验操作能力及计算能力,明确操作步骤、误差分析、物质的量浓度计算方法即可解答,易错点是误差分析.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于52% | B. | 等于52% | C. | 小于52% | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由该氯原子构成氯分子(Cl2)的相对分子质量为$\frac{24a}{b}$ | |
| B. | mg该氯原子的物质的量为$\frac{m}{aNA}$ mol | |
| C. | ng该氯原子所含的电子数为$\frac{17n}{aNA}$ | |
| D. | 1mol该氯原子的质量为aNA g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
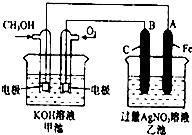 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com