
利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.lmol/L盐酸过程中的电导率曲线。下列说法错误的是
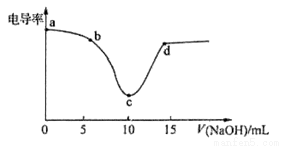
A.电导率传感器能用于判断酸碱中和滴定的终点
B.该过程中,a点所示溶液的导电性最强
C.c点电导率最小是因为此时溶液中导电微粒数目最少
D.d点所示溶液中存在:c(Cl一)+c(OH一)=c(H+)+c(Na+)
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2015-2016学年浙江省温州市十校联合高二下期中化学试卷(解析版) 题型:计算题
某有机物的蒸气密度是空气的3.52倍,该有机物4.08g 充分燃烧后产生的CO2和H2O的物质的量之比为1:1,通过盛碱石灰的干燥管后,干燥管增重12.4g,
(1)计算并写出该有机物的分子式
(2)该有机物具有以下性质:能与银氨溶液反应,可在酸或者碱催化下水解,含有手性碳原子。试写出该有机物的结构简式。
查看答案和解析>>
科目:高中化学 来源:2016届河南省原推荐高三四月高考仿真模拟理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA
B.常温常压下,1L0.1mol·L-1的硝酸铵溶液中氮原子数目为0.2NA
C.1mol有机物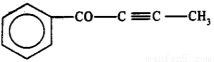 中最多有6NA个原子在一条直线上
中最多有6NA个原子在一条直线上
D.1mol甲基(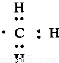 )所含的电子数为7NA
)所含的电子数为7NA
查看答案和解析>>
科目:高中化学 来源:2016届广东省佛山市高三4月二模理综化学试卷(解析版) 题型:实验题
用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:
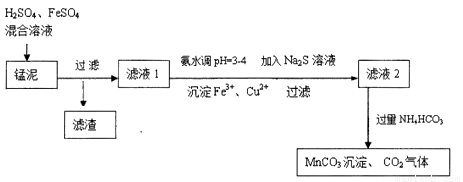
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是
(2)除去滤液1中Cu2+的离子方程式是
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/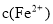 <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe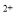 ;
;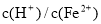 ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想试剂是_(填序号)
a.NaOH溶液 B.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高考模拟理综化学试卷(解析版) 题型:实验题
由合成气制备乙醇一般有两种方法:
(1)直接合成法①2CO2(g) + 6H2(g)  CH3CH2OH(g) + 3H2O(g) △H1
CH3CH2OH(g) + 3H2O(g) △H1
②2CO(g) +4H2(g)  CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇。其生产流程如下图所示:
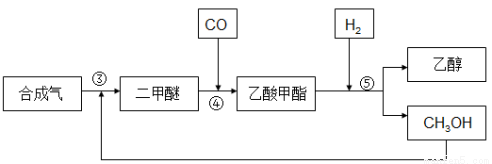
③ 3CO(g) + 3H2(g)  CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
④ CH3OCH3(g) + CO(g)  CH3COOCH3(g)
CH3COOCH3(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:

①反应①的△H1 0,△S 0。(填“>”、“<”或“=”)
②已知CO(g) + H2O(g)  CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线。
(2)对反应③处于化学平衡状态时的描述,正确的是 。(填字母)。
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是 。
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%。则氢气的反应速率v(H2)= ,平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高考模拟理综化学试卷(解析版) 题型:选择题
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等,Z为非金属性最强的元素。下列说法正确的是
A、原子半径:W>Y>Z,而简单离子的半径:Z>Y>W
B、W的氯化物水溶液中通入XY3至过量,现象是先生成白色沉淀,后逐渐溶解
C、Z的非金属性强于Y,因此其最高价氧化物对应水化物的酸性强于Y
D、YX3沸点远高于YZ3的原因是YX3存在分子间氢键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下期中化学试卷(解析版) 题型:填空题
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为
________________________________________________________________________。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。

正极反应式:_____________________________________________________________。
负极反应式:______________________________________________________________。
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):______________________,用离子方程式表示其反应原理:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期中化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.9g甲基(-CH3)所含有的电子数是10NA个
B.22.4L乙烷中含有的共价键数为7NA个
C.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个
D.4.2gC3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com