
分析 Ⅰ.(1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O;根据原子守恒判断b、c关系;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6;
②该反应中Fe元素化合价由+3价升高到+6价,Cl元素化合价由+1价变为-1价,转移电子数为6,根据转移电子和高铁酸根离子之间关系式计算转移电子物质的量、根据转移电子和还原产物之间关系式计算还原产物物质的量;
Ⅱ.由2Fe3++2I-=2Fe2++I2;2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应,结合碘化亚铁、溴化亚铁的物质的量及氯气的物质的量、电子守恒进行分析、计算即可.
解答 解:Ⅰ.(1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为:2FeSO4+6Na2O2 $\frac{\underline{\;高温\;}}{\;}$2Na2FeO4+2Na2O+2Na2SO4+O2↑,可知b=2c,
故答案为:Na2O;b=2c;
(2 ) ①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6,溶液在碱性条件下进行,则氢氧化根离子参加反应,生成水,反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中Fe元素化合价由+3价升高到+6价,则该反应中转移电子数为6,每生成1mol FeO42-转移电子物质的量=$\frac{6mol}{2}$=3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=$\frac{0.3mol}{6}$=0.15mol,
故答案为:3;0.15;
Ⅱ.(1)向含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI-、2molFe 2+,
故答案为:n(I-)=2mol、n(Fe2+)=2mol;
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,Fe2+失去的电子的物质的量为(a+b)mol,I-失去的电子的物质的量为2amol,Br-失去的电子的物质的量为2bmol,则共失去3(a+b)mol电子,所以需要氯气的物质的量为c=$\frac{3(a+b)}{2}$mol,
故答案为:c=$\frac{3(a+b)}{2}$.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,正确判断各个物理量之间关系式是解本题关键,难点是化学反应方程式的配平,要注意原子守恒、转移电子守恒及电荷守恒,题目难度不大.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的分子数为0.5 NA | |
| B. | 12 g石墨和C60的混合物中质子总数一定为6NA个 | |
| C. | 在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
| C | FeCl3+3KSCN?Fe(SCN)3+3KCl 平衡体系中加入少量KSCN固体,溶液颜色加深 | 恒温时增大反应物浓度,平衡向正反应方向移动 |
| D | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. |  图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  图表示0.100 0 mol•L-1NaOH溶液滴定20.00 mL 0.100 0 mol•L-1醋酸溶液得到的滴定曲线 | |
| D. |  表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
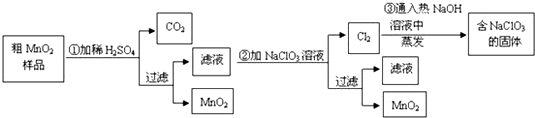
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com