
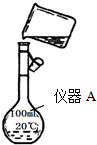
 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2分析 Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3,所以在制取氢氧化亚铁时,要隔绝氧气.打开止水夹时,装置I中产生的氢气通过导管进入装置II中,当装置II中的空气全部排出时收集到的氢气为纯净的氢气,此时装置II中不含氧气对反应生成的氢氧化亚铁不再产生影响;当夹紧止水夹,装置I内产生的氢气不能排出而使装置内压强增大,反应后的硫酸亚铁溶液由导管进入装置II而与装置II中的氢氧化钠溶液发生反应,生成氢氧化亚铁.
解答 解:(1)铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,所以在试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,故选A;
(2)打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后检验A口排出气体的纯度,氢气纯时,说明空气排尽,关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2.若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,所以在试管Ⅰ和Ⅱ中加入试剂后的实验操作依次是:打开止水夹;检验A口排出气体的纯度;夹紧止水夹;故答案为:检验A口排出气体的纯度;
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,原因是试管Ⅰ中反应生成的氢气,充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以不容易被氧化,
故答案为:试管Ⅰ中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
点评 本题考查物质的制备,透彻理解教材上的实验原理,掌握方案设计的基本思路和方法是解答的关键,注意Fe(OH)2很容易被空气中的氧气氧化,这是Fe(OH)2的重要性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4 能与水缓慢反应生成Fe(OH)3 和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 太阳能、风能是可再生能源,应大力推广太阳能、风能的使用 | |
| D. | 新型能源生物柴油和矿物油的主要化学成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
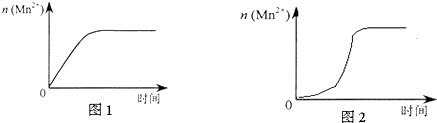
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是用量最大、用途最广的合金,根据其化学成分可分为高碳钢和低碳钢两大类 | |
| B. | 二氧化硫、二氧化氮是主要的大气污染物,它们能直接危害人体健康还能形成酸雨,酸雨的PH值通常小于6.5 | |
| C. | 多糖和蛋白质都是在生命活动中能起到重要作用的高分子化合物,它们的水解产物都属于烃的衍生物 | |
| D. | 合成高分子材料在现代生活中发挥着极大的作用,聚苯乙烯、酚醛树脂、涤纶、顺丁橡胶都是由单体缩聚形成的体型高分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com