
| A、进行纸层析操作时,要让层析试纸上的点样点进入展开剂,进行展开 |
| B、在酸性K2Cr2O7溶液中滴加亚硝酸钠溶液,溶液会变绿色 |
| C、乙酸和乙醇的混合液可用分夜漏斗进行分离 |
| D、用盐酸标准液滴定待测的氢氧化钠时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |


科目:高中化学 来源: 题型:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | A | B | K | |||||
| 3 | C | D | E | F | G | H | I | |
| 4 | J |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子晶体干冰易汽化,可用作制冷剂 |
| B、原子晶体干冰有很高的熔点和沸点 |
| C、原子晶体干冰的硬度小,不能用作耐磨材料 |
| D、1 mol原子晶体干冰中含2 mol C-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
| B、向0.1mol?L-1的FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有漂白性 |
| C、将碘水倒入分液漏斗中,加入适量乙醇,振荡后静置,可降碘萃取到乙醇中 |
| D、向锌粒与稀H2SO4的反应溶液中加入CuSO4,产生气泡的速度加快,说明CuSO4对此反应有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
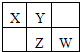 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )| A、四种元素的氢化物中,Y的氢化物沸点最高 |
| B、Z的单质不溶于水,有多种同素异形体 |
| C、阴离子的还原性:X<Y |
| D、X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a<b时,c>(a+b) |
| B、若a<b时,c<(a+b) |
| C、若a>b时,c=(a+b) |
| D、若a=b时,c=(a+b) |
查看答案和解析>>
科目:高中化学 来源: 题型:
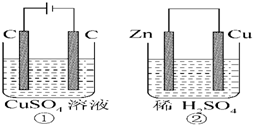 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.2mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中错误的是( )
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.2mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中错误的是( )| A、电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:2H++2e-═H2↑ |
| B、①中溶液的pH和②中溶液的PH相同 |
| C、①中SO42-向阳极移动,②中SO42-向铜片附近移动 |
| D、两个装置中产生的气体的体积之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com