
| A. | 向等体积的①、②溶液中分别加水稀释100倍后,溶液的pH:①<② | |
| B. | 将等体积的①、③溶液分别与足量铝粉反应,生成H2的物质的量相等 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:①>④ |
分析 常温下水电离出的c(H+)均为1×10-13mol/L,则溶质抑制了水的电离,该溶液为酸溶液或碱溶液,①③为强电解质,都是一元强酸或强碱,则二者浓度为0.1mol/L;②④为弱电解质,在溶液中只能部分电离,则其浓度大于0.1mol/L,
A.加水稀释后,弱酸的电离程度增大,则弱酸溶液的pH小于强酸;
B.铝足量,酸、碱溶液完全反应,根据浓度大小及氢离子、氢氧根离子与生成氢气的量的关系判断;
C.根据分析可知,醋酸浓度大于氢氧化钠,混合液中醋酸过量,溶液显示酸性;
D.氨水的浓度大于氯化氢溶液,若要使混合液为中性,则氯化氢溶液体积应该大于氨水.
解答 解:常温下水电离出的c(H+)均为1×10-13mol/L,则溶质抑制了水的电离,该溶液为酸溶液或碱溶液,①③为强电解质,都是一元强酸或强碱,则二者浓度为0.1mol/L;②④为弱电解质,在溶液中只能部分电离,则其浓度大于0.1mol/L,
A.由于加水稀释100倍后,弱电解质电离程度增大,溶液中弱酸电离出的氢离子、弱碱的电离出的氢氧根离子的物质的量增大,所以强电解质溶液的pH变化为2,弱电解质溶液的pH变化小于2,故稀释后溶液的pH大小为:①>②,故A错误;
B.铝足量时,2mol HCl反应生成1mol氢气,2molNaOH反应生成3mol氢气,①③的浓度相等,所以③生成的氢气大于,故B错误;
C.②、③溶液等体积混合后,由于醋酸浓度大于氢氧化钠溶液,则混合液中醋酸过量,反应后的溶液显示酸性,故C错误;
D.①、④溶液混合若pH=7,由于氨水的浓度大于氯化氢溶液,则消耗氯化氢溶液的体积应该加大,即:消耗溶液的体积:①>④,故D正确;
故选D.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确酸碱溶液对水的电离的影响为解答关键,注意明确弱电解质在溶液中部分电离,试题侧重考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Q<W | |
| B. | ZX3可使紫色石蕊溶液变蓝 | |
| C. | X、Z、Q三种元素可组成离子化合物或共价化合物 | |
| D. | X2Q2、Y2X6两种分子中含有的电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
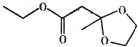
| A. | 苹果酯分子中含有14个氢原子 | |
| B. | 苹果酯能在NaOH溶液中发生水解反应 | |
| C. | 苹果酯能与金属钠反应产生氢气 | |
| D. | 苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
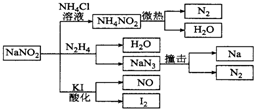
| A. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI-淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2转移6 mole一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B的物质的量浓度 | D. | 气体的总物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com