
有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,其中A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,B、F同主族,且C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,E元素在地壳中的含量仅次于氧,请用化学用语回答下列问题:
(1)写出A、C两种元素组成的化合物的电子式:____________;
(2)B、F的氢化物沸点较高的为____________;
(3)C、D与氧元素形成的常见化合物的水溶液呈碱性,其原因是 (用离子方程式表示)
(4)C、D、B按质量比为23:9:38组成一种化合物,化合物中含有的化学键类型有_______________;
(5)E可与氧元素通过共价键形成原子晶体,其晶胞可看作是在晶体E的晶胞中插入了_______个氧原子。
(1)Na+[:H-]
(2)HF
(3)AlO2- +2H2O  Al(OH)3+OH-
Al(OH)3+OH-
(4)离子键、共价键(配位键)
(5)16
解析试题分析: E元素在地壳中的含量仅次于氧,则E为Si元素,F比E大,且最外层电子数比C多6,则满足此关系的F最外层为7个电子,C为1个电子,F为Cl,B为F元素,C为Na,C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,则D为Al元素,A与C能形成化合物且同主族,则A为H元素,所以A、B、C、D、E、F分别为H、F、Na、Al、Cl元素。
(1)A、C两种元素组成的化合物为NaH,是离子化合物,所以其电子式为:Na+[:H-]。
(2)B、F的氢化物分别为HF、HCl,因为HF分子之间形成氢键,作用力较强,所以沸点较高的为HF。
(3)C、D与氧元素形成的常见化合物为NaAlO2,是一种强碱弱酸盐,所以水溶液呈碱性,水解的离子方程式为:AlO2- +2H2O  Al(OH)3+OH- 。
Al(OH)3+OH- 。
(4)C、D、B按质量比为23:9:38组成一种化合物,可以通过各原子的相对分子质量推出化合物的化学式为Na3AlF6 ,该物质中含有离子键和共价键。
(5)单质E是晶体硅,为立体空间结构,每个单元为Si四面体,E与氧元素形成的化合物为SiO2也是立体空间结构,每个单元为Si-O四面体,所以SiO2晶体可以看成是在晶体E的晶胞中插入了16个个氧原子。
考点:本题考查的是元素化合物推断。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示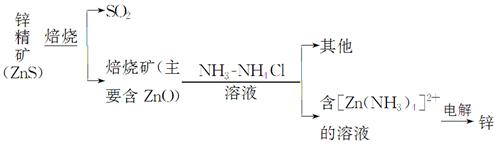
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
)已知甲、乙、丙、丁、戊、己为短周期元素形成的六种粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核单质分子,可与水发生置换反应,甲的电子式为 。
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,该反应的离子方程式为 。
(3)丙为含两种元素的分子,且原子个数比为1∶1,实验室中可以用丙制备氧气,反应的化学方程式为 。
(4)戊属于烃,已知1 g戊在氧气中完全燃烧放出52 kJ的热量,戊燃烧的热化学方程式为 。
(5)己为两种元素组成的六原子分子,常用作火箭的燃料,则己的化学式为 ______________ ,分子中含有的化学键为 (填“离子键”或“共价键”)。己与丙反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是 ,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Z的最髙价含氧酸,写出此反应的化学方程式 。.
(3)比较Y、W性质的活泼性 (用一个化学反应方程式表示)。
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。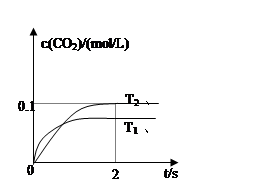
据此判断:
该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)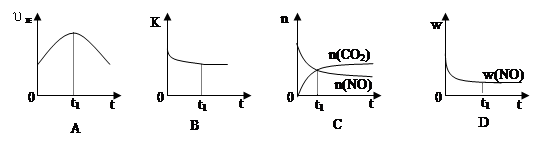
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在元素周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成______________外,也生成微量的________________。
(2)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇足量强碱溶液反应的离子方程式为_____________________________________________________________。
(3)科学家证实,BeCl2是共价化合物,可以设计一个简单实验证明,该实验方法是:____________________________________________________________________________。
用电子式表示BeCl2的形成过程:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的电子排布图是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)U、V、X、Y、Z五种短周期元素,原子序数依次增大。U、V两元素最高正价与最低负价之和均为0;Y与U同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(用实际元素符号表示)________________;
(2)由这五种元素中的几种组成的化合物A、B、C、D有如下转化关系:
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式:___________________;
①如果B为两性不溶物,则A的化学式为_________,A转化为B的离子方程式为:__ __________;
②如果B由四种元素组成且溶液显碱性,则B含有的化学键类型是_______,A所属物质类别为_ ___________(填选项序号)。a.酸 b.碱 c.盐 d.氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com