
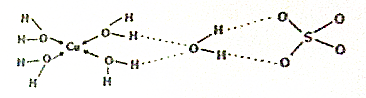
分析 根据硫酸铜晶体的结构图,结合250g硫酸铜晶体的物质的量为$\frac{250}{250}$=1mol,102℃时固体质量为241g,减少的质量为250-241=9g,113℃时固体质量为178g,减少的质量为250-178=72g,进行计算分析.
解答 解:250g硫酸铜晶体的物质的量为$\frac{250}{250}$=1mol,根据硫酸铜晶体的结构图,5个结晶水1个以氢键结合,4个以配位键结合,所以加热分解时首先破坏氢键失去1个结晶水,再破环4个以配位键失去4个结晶水,而102℃时固体质量为241g,减少的质量为250-241=9g,即减少$\frac{9}{18}$=0.5mol结晶水,则102℃时破坏的作用力为氢键;113℃时固体质量为178g,减少的质量为250-178=72g,即减少$\frac{72}{18}$=4mol结晶水,则113℃时破坏的作用力为配位键,
故答案为:氢键;配位键.
点评 本题主要考查了硫酸铜晶体在受热时破坏的作用力的分析,难度不大,注意硫酸铜晶体的结构特征以及数据计算.


科目:高中化学 来源: 题型:填空题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青石棉不属于硅酸盐原料 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉属于新型无机非金属材料 | |
| D. | 1 mol青石棉能使1 mol稀硝酸被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com