

分析 (1)根据各种仪器的作用选取仪器,注意取用块状固体药品时用镊子,据此分析;
(2)①根据类比金属钠的物理性质进行解答;
②钾性质活泼,易与氧气、水等剧烈反应,金属性比钠强,可结合题意和Na的性质书写有关方程式;
④该小组在分类的基础上进行实验,通过观察实验现象得出结论;
(3)①氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,据此判断解答;
②铜粉在氯气中燃烧生成氯化铜;
③氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水.
解答 解:(1)实验室里做钠跟水反应的实验时,取用块状固体药品时用镊子,将金属钠放在玻璃片上,用小刀切一小块钠,用滤纸擦干表面的煤油,用烧杯盛放水,用玻璃棒覆盖烧杯,防止钠飞出,所以用到的仪器是镊子、小刀、滤纸、烧杯、玻璃片,则是bcegj;
故答案为:bcegj;
(2)①碱金属硬度减小,一般为银白色,所以钾的硬度小,颜色为银白色,
故答案为:小; 银白;
②)①金属钾在空气中缓慢氧化生成的是氧化剂,反应的化学方程式为:4K+O2═2K2O,
故答案为:4K+O2═2K2O;
②由题意可知,钾在空气中燃烧的产物是超氧化钾(KO2),反应的化学方程式为K+O2$\frac{\underline{\;点燃\;}}{\;}$KO2,
故答案为:K+O2$\frac{\underline{\;点燃\;}}{\;}$KO2;
④首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处.然后预测性质并通过实验验证,通过实验现象,通过观分解释、整合,进而得出结论,所以该小组研究钾的性质用到了观察、实验、分类、比较的方法,
故答案为:观察、实验、分类、比较;
(3)①氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以可以用盛有饱和食盐水的B除去氯气中混有的氯化氢;
故答案为:除去氯气中混有的氯化氢气体;
②铜粉在氯气中燃烧生成氯化铜,化学方程式:Cu+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ CuCl2;
故答案为:Cu+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ CuCl2;
③氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查同主族金属元素性质的探究,氯气的制备和性质的检验,题目难度不大,注意根据同主族元素的金属性的相似性和递变性分析该题,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
从海带中提取碘单质,成熟的工艺流程如下:

下列关于海水制碘的说法不正确的是
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能被银氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol该有机物只能与1molBr2发生加成反应 | |
| D. | 1mol该有机物只能与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

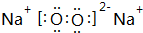 .
.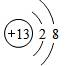 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )| A. | 反应 I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A与状态B相比,状态A的c(I2)大 | |
| C. | 若反应进行到状态D时,一定有v逆>v正 | |
| D. | 若温度为T1、T2,反应的平衡常数K1、K2则 K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油加水作护肤剂 | |
| B. | 医用酒精的浓度为75% (体积比浓度) | |
| C. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,因此可以用其保鲜鱼肉等食品 | |
| D. | 苯酚有毒但可以制成药皂,具有杀菌消毒的功效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com