
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③④ | B. | 只有①②④ | C. | 只有②③④ | D. | 只有①②③ |
分析 ①生成乙炔中混有硫化氢,二者均具有还原性;
②发生水解反应后,溶液显碱性,NaOH与硝酸银反应;
③水解后,溶液为酸性,检验水解产物葡萄糖应在碱性溶液中;
④发生消去反应生成乙烯,可能混有二氧化硫.
解答 解:①生成乙炔中混有硫化氢,二者均具有还原性,则需加CuSO4溶液除杂后,再用KMnO4酸性溶液检验乙炔的还原性,故选;
②发生水解反应后,溶液显碱性,NaOH与硝酸银反应,则需加HNO3溶液中和至酸性,再用AgNO3溶液检验CH3CH2Br中的Br,故选;
③水解后,溶液为酸性,检验水解产物葡萄糖应在碱性溶液中,则需要NaOH溶液中和至碱性,再用银氨溶液检验水解产物的还原性,故选;
④发生消去反应生成乙烯,可能混有二氧化硫,则需加NaOH溶液除杂后,再用Br2的CCl4溶液证明该反应为消去反应,故选;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的性质、检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | h1>h2>h3>h4 | B. | h4>h3>h2>h1 | C. | h4>h1>h3>h2 | D. | h2>h3>h1>h4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①常用于互溶但沸点不同的液体混合物的分离 | |
| B. | 用装置②可除去NO2中的NO | |
| C. | 装置③可用于吸收NH3或HCl气体,并防止倒吸 | |
| D. | 装置④可用于制备Fe(0H)2并能 较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | 物质 | 结构式 | 水中溶解度/g(25℃) | 熔点/℃ |
| A | 邻-硝基苯酚 | 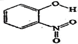 | 0.2 | 45 |
| B | 对-硝基苯酚 | 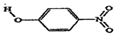 | 1.7 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-=Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | 3Mg2++2H++4SO42-+4Ba2++8OH-=3Mg(OH)2↓+4BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| ① | 将足量的SO2气体通入装有品红溶液的试管中 | 研究SO2具有漂白性 |
| ② | 向盛有10molAgNO3溶液的试管中滴加几滴NaCl溶液,再向其中滴加几滴Na2S | 比较Ksp(AgCl)与Ksp(Ag2S)的大小 |
| ③ | 测定等物质的量浓度HCl,HNO3的pH | 比较Cl,N的非金属性强弱 |
| ④ | 向2支试管中加入同体积通浓度的H2C2O4溶液,再分别加入同体积不同浓度的酸性KMnO4 | 研究浓度对反应速率的影响 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com