
有一瓶14%的KOH溶液,加热蒸发掉100 g 水后,变为28%的KOH溶液80 mL,该80 mL 溶液的物质的量浓度为( )
A.5 mol/L B.6 mol/L
C.6.25 mol/L D.6.75 mol/L
科目:高中化学 来源: 题型:
在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117~125kJ·mol-1的能量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热为23.4kJ·mol-1,以上事实表明( )
A.1,3-环己二烯加氢是吸热反应
B.1,3-环己二烯比苯稳定
C.苯加氢生成环己烷是吸热反应
D.苯比1,3-环己二烯稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,既能因发生化学反应而使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
①CH3CH2CH2CH3 ②CH3CH2CH===CH2
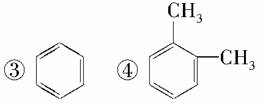
A.①②③④ B.②③④
C.②④ D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烃RX(R是烷基,X是某种卤素原子)的密度是a g/cm3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烃b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀。
④过滤、洗涤,干燥后称重,得到固体c g。
回答下面问题:
(1)装置中玻璃管的作用是________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________离子。
(3)该卤代烃中所含卤素的名称是_______,判断的依据是______。
(4)该卤代烃的相对分子质量是________(列出算式)。
(5)如果在步骤③中,所加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值________(填下列选项代码)。
A.偏大 B.偏小
C.不变 D.大小不定
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL 0.3 mol/L Na2SO4溶液和50 mL 0.2 mol/L Al2(SO4)3溶液混合后,溶液中SO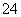 的物质的量浓度为( )
的物质的量浓度为( )
A.0.20 mol/L B.0.25 mol/L
C.0.40 mol/L D.0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度肯定为1 mol/L的是( )
A.将40 g NaOH固体溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol/L浓盐酸稀释配成10L溶液
D.10 g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
9.2 g金属钠投入到足量的重水中,则产生的气体中含有( )
A、0.2 mol中子
B、0.4 mol电子
C、0.2 mol质子
D、0.4 mol分子
查看答案和解析>>
科目:高中化学 来源: 题型:
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
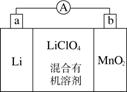
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com