
| A. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向NaAlO2溶液中通入少量的CO2的反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| C. | FeBr2与足量的Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
分析 A.氢氧化钠过量,铵根离子、碳酸氢根离子都反应;
B.二氧化碳少量,反应生成氢氧化铝沉淀和碳酸钠;
C.氯气足量二价铁离子、溴离子全部被氧化;
D.高锰酸钾能够氧化氯化氢.
解答 解:A.向NH4HCO3溶液中加过量的NaOH溶液并加热,离子方程式:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故A错误;
B.向NaAlO2溶液中通入少量的CO2反应生成氢氧化铝沉淀和碳酸钠,反应离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故B正确;
C.FeBr2与足量的Cl2反应,离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.浓盐酸具有还原性,能够还原酸性的高锰酸钾,所以盐酸酸化会对过氧化氢还原性检验造成干扰,故D错误;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+586.0kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未完全反应 | ||
| C. | 参加反应的盐酸有一半被氧化 | D. | 反应产生2.24L氯气(标况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .常温常压下,18 g H2O中含有的电子总数为10NA | |
| B. | .1 mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为3 NA | |
| D. | 标准状况下,2.24LCH4所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是有机化合物 | B. | 都能发生酯化反应 | ||
| C. | 都是纯净物 | D. | 水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:填空题
将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g)  2HI(g) △H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g) △H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
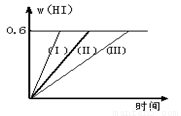
(1)达平衡时,I2(g)的物质的量浓度为mol/L 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是 ,则乙条件可能是 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入正催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入2mol I2(g)、4mol H2(g)发生反应,达平衡时,HI的体积分数是 0.6(填大于、等于、小于)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
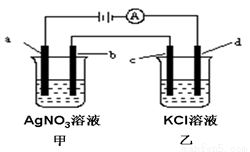
A.乙烧杯中的d电极反应式为Fe-2e-=Fe2+
B.电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀
C.当b极增重5.4g时,d极产生的气体为2.24L(标况)
D.甲烧杯中溶液的pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com