
分析 A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是短周期中金属性最强的元素,则B为Na;结合原子序数可知,C、D、E、F都处于第三周期,C是同周期中阳离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si、M为Na2SiO3;E的最外层电子数与内层电子数之比为3:5,则最外层电子数为6,故E为硫元素,F的原子序数最大,故F为Cl,据此解答.
解答 解:A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是短周期中金属性最强的元素,则B为Na;结合原子序数可知,C、D、E、F都处于第三周期,C是同周期中阳离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si、M为Na2SiO3;E的最外层电子数与内层电子数之比为3:5,则最外层电子数为6,故E为硫元素,F的原子序数最大,故F为Cl,
(1)F为Cl元素,在元素周期表中的位置为:第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)A为碳、E为S,碳酸为弱酸,硫酸为强酸,则S的非金属性比碳的强,故得电子能力C<S,故答案为:弱于;
(3)M为硅酸钠,其水溶液俗称水玻璃,故答案为:水玻璃;
(4)Na单质与氧气反应的产物、Al单质同时放入水中,产生两种无色气体,有关的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,氧气与氢气恰好反应,则二者物质的量之比为1:2,设氧气为1mol,则与氧气反应的Na单质为4mol,放入水中的Al单质为$\frac{4}{3}$mol,二者质量之比为4×23:$\frac{4}{3}$×27=23:9,
故答案为:23:9;
(5)S2Cl2与水反应生成一种能使品红溶液褪色的气体为二氧化硫,只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S+SO2↑+4HCl,
故答案为:2S2Cl2+2H2O═3S+SO2↑+4HCl.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生运用知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:解答题
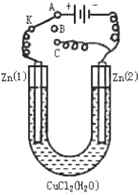 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的一极为正极,该极c(OH-)减小 | |
| B. | 通入甲烷的一极的电极反应为CH4-8e-+3H2O=CO32-+10H+ | |
| C. | 通入氧气一极发生还原反应,电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法分离植物油和水的混合物 | |
| B. | 乙烷中含有少量乙烯,提纯乙烷,用酸性高锰酸钾溶液洗气 | |
| C. | 用热的纯碱(Na2CO3)溶液洗涤餐具上的油污 | |
| D. | 粗铜精炼时,粗铜做电解池的阳极,纯铜做阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com