
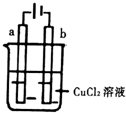
| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 当电路中通过0.2mol电子时,理论上b电极质量增加6.4g |
分析 由图可知为电解池,用惰性电极电解氯化铜溶液,a连接电源正极为阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,b连接电源负极为阴极发生还原反应,电极方程式为Cu2++2e-=Cu,以此解答该题.
解答 解:A.a为电解池的阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,产生氯气,没有铜析出,故A错误;
B.b与电源的负极相连,为电解池的阴极,故B错误;
C.电解池中电子从电源的负极流向电解池的阴极b,然后从阳极流向电源的正极a,故C错误;
D.依据Cu2++2e-=Cu,可知转移2mol电子生成1mol铜,则当电路中通过0.2mol电子时,理论上b电极质量增加6.4g,故D正确;
故选:D.
点评 本题考查电解原理,准确判断电解池阴阳极及电极发生反应是解题关键,题目难度不大,注重基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 乙烯和聚乙烯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol苯分子中含有碳碳双键数为3NA | |
| D. | 要检验溴乙烷中的溴元素,可加入Na0H溶液共热一会儿,冷却后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2互为同素异形体 | B. | O2和O3互为同位素 | ||
| C. | 乙醇和二甲醚互为同分异构体 | D. | 12C、13C为同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com