
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
【答案】B
【解析】A.将Na2CO3溶液用水稀释后,pH变小,Kw不变,故A错误;B.向有AgCl固体的饱和溶液中加少许水,溶液仍为AgCl的饱和溶液,此时c(Ag+)和Ksp(AgCl)都不变,故B正确;C.pH=4.75、浓度均为0.1molL-1的CH3COOH和CH3COONa的混合溶液中存在电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),中醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,醋酸是弱电解质,溶液中c(CH3COOH)<c(Na+),c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C错误;D.含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则有二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液的浓度的10倍,设pH为2的醋酸浓度为x,PH=3的醋酸浓度为y,则有Va×x=Vb×y,则![]() ,即Vb>10Va,故D错误;答案为B。
,即Vb>10Va,故D错误;答案为B。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】1981年,Thoms Cech在研究四膜虫时,发现其rRNA前体加工除去某些片段的过程中发生“剪接反应”,该反应是在仅有RNA没有任何蛋白质参与的情况下完成的。下列推论最合理的是( )
A.该反应不需要酶的催化 B.四膜虫体内的这种RNA具有酶的特性
C.所有蛋白质和RNA都是酶 D.有的DNA也可能是酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2﹣CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( ) 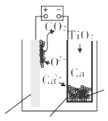
A.由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子
B.阳极的电极反应式为 C+2O2﹣﹣4e﹣═CO2↑
C.在制备金属钛前后,整套装置中 CaO 的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列提供的一组物质回答问题:
①NH4Cl ②MgCl2 ③H2S ④Na2O2 ⑤MgO ⑥Cl2 ⑦NaOH ⑧CH4 ⑨NH3 ⑩CO2
(1)仅含有共价键的是_____;既有离子键又有共价键的是_____(用序号表示)
(2)离子化合物有_____;共价化合物有______(用序号表示)
(3)MgCl2 的电子式______;NH3 的电子式_____;Na2O2 的电子式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在元素周期表中所处的位置如图所示,A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是
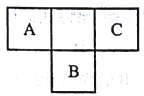
A. B的气态氢化物比C的气态氢化物稳定
B. 元素D形成的气态氢化物一定是正四面体形分子
C. A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
D. 四种元素的原子半径:B>D>A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃蒸气的质量是相同状况下同体积氢气质量的36倍,该烃的化学式是 , 它有种同分异构体,其中沸点最高的是 , 一氯代物只有一种结构的是(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 .
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
CO | H2 | CH3OH |
0.5molL﹣1 | 2molL﹣1 | 6molL﹣1 |
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“>”“<”或“═”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com