
工业上常用还原沉淀法处理含铬废水(Cr2 和Cr
和Cr ),其流为:
),其流为:
Cr
 Cr2
Cr2
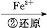 Cr3+
Cr3+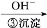 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr (黄色)+2H+
(黄色)+2H+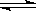 Cr2
Cr2 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 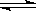 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr 浓度增大
浓度增大
B.步骤①中当2v(Cr )=v(Cr2
)=v(Cr2 )时,说明反应2Cr
)时,说明反应2Cr (黄色)+2H+
(黄色)+2H+  Cr2
Cr2 (橙色)+H2O达到平衡状态
(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O
,需要12 mol (NH4)2Fe(SO4)2·6H2O
D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高一上学期期中测试化学试卷(解析版) 题型:选择题
下列各组物质中,按单质、化合物、混合物顺序排列的是
A.金属钙、生石灰、碱石灰 B.铁、四氧化三铁、冰水混合物
C.水银、空气、干冰 D.二氧化硫、水蒸气、天然气
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期期中测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
A.Y可用于制造高性能可充电电池
B.WX3的沸点高于ZX3
C.Z的最高价含氧酸的酸性弱于W的最高价含氧酸的酸性
D.原子半径的大小顺序:rW>rZ>rY>rX
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高三上学期期中测试化学试卷(解析版) 题型:选择题
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤后,剩余沉淀质量为2.33 g。
根据上述实验,以下推测正确的是
A.K+一定存在,且c(K+)≥0.2mol·L―1
B.100 mL溶液中含CO32― 0.01mol
C.K+不一定存在
D.Cl― 一定存在
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
由铝屑、盐酸、氢氧化钠溶液反应制取1mol Al(OH)3,至少需要消耗HCl和NaOH的物质的量为
A.0.25mol,0.25mol B.0.75mol,0.75mol
C.1mol,1mol D.3mol,3mol
查看答案和解析>>
科目:高中化学 来源:2016届湖北省枣阳市高三上学期10月月考理综化学试卷(解析版) 题型:选择题
分子式与苯丙氨酸( )相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是
)相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是
A.3 B.5 C.6 D.10
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:填空题
硫-氨热化学循环制氢示意图如下:
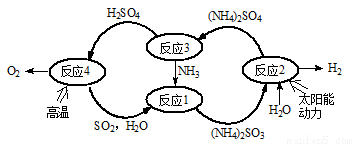
(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g),△H=+177kJ•mol-1 …………(a)
2SO3(g) 2SO2(g) + O2(g),△H=+196 kJ•mol-1…………(b)
2SO2(g) + O2(g),△H=+196 kJ•mol-1…………(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如右图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。

i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高一10月月考化学试卷(解析版) 题型:填空题
Ⅰ、取少量Fe2O3粉末,向其中加入适量盐酸使其充分溶解。
(1)上述反应的化学方程式为 反应后得到的溶液呈 色。
(2)取少量上述溶液,置于试管中,滴入NaOH溶液,可观察到有 色沉淀生成,发生反应的化学方程式为:此反应属于 (填基本反应类型)反应。
Ⅱ、(3)在甲烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 FeCl3 溶液,继续煮沸直至溶液呈 色,停止加热,即可以制得Fe(OH)3胶体。制备Fe(OH)3胶体的化学方程式:
(4)另取乙烧杯,加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,震荡均匀后,将乙烧杯与甲烧杯一起置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生 ,这个实验可以用来区别 。
(5)取甲烧杯中的少量Fe(OH)3胶体于试管中,向试管中逐滴滴加稀盐酸,
现象: ,原因: ,
如果有反应,方程式为:
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写不正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+= BaSO4↓+ NH3•H2O+H2O
B.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:
2Fe3++SO2+2H2O == 2Fe2++SO42-+ 4H+
C.硫化钠的水解:S2-+ H2O H S-+ OH-
H S-+ OH-
D.NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com