
【题目】m、n、x、y四种主族元素在周期表的相对位置如图所示。已知它们的原子序数总和为46,则:
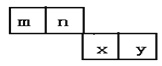
(1)元素n的气态氢化物的电子式为___,基态n原子的核外共有__种不同运动状态的电子。
(2)m与y所形成的化合物含___键,属___分子。(填“极性”或“非极性”)
(3)x位于周期表的第___周期第___族;其简单离子的离子结构示意图为___。
【答案】![]() 7 极性 非极性 三 VIA
7 极性 非极性 三 VIA 
【解析】
设m的原子序数是a,根据m、n、x、y四种主族元素在周期表的相对位置,n、x、y的原子序数是a+1、a+10、a+11,a+a+1+a+10+a+11=46,a=6,所以m、n、x、y四种主族元素分别是C、N、S、Cl。
(1) n是N元素,N的气态氢化物是NH3,电子式为![]() ,核外电子的运动状态都不同,基态N原子的核外共有7个电子,所以有7种不同运动状态的电子。
,核外电子的运动状态都不同,基态N原子的核外共有7个电子,所以有7种不同运动状态的电子。
(2)C与Cl所形成的化合物是CCl4,含极性共价键,CCl4分子结构对称,属非极性分子;
(3)S元素位于周期表的第三周期第VIA族;其简单离子S2-的核外有18个电子,离子结构示意图为 。
。


科目:高中化学 来源: 题型:
【题目】今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为VL;③pH=2的硫酸;④pH=12的氢氧化钠溶液。下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大10倍,所得溶液pH变为(a-1)
B.V1L③溶液和V2L④溶液混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④两溶液等体积混合,混合液pH=7
D.①与③两溶液的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下列可用于分离和提纯物质的方法是
(1)分离NaCl溶液中的NaCl和水_________;
(2)分离乙醇和水的混合物___________;
(3)分离溴水中的溴和水_________;
(4)除去澄清石灰水中悬浮的CaCO3颗粒________;
II、掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:①_____________④______________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器__________;该分离操作的名称为__________;进行I分离操作时进水口为______(填f或g)。
(3)现需配制1000mL某溶液,其中装置II是该同学转移溶液的示意图,该同学操作的错误是_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分难溶物的颜色和常温下的Ksp如下表所示:
Cu(OH)2 | CuOH | CuCl | Cu2O | |
颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |
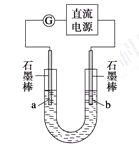
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是_______。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。

观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是_____,原因是___________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液作![]() 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品![]()
(1)若某次捕捉后得到![]() 的溶液,则溶液中
的溶液,则溶液中![]() :
:![]() ______
______![]() 常温下
常温下![]() 、
、![]() ,
,
(2)欲用5L![]() 溶液将
溶液将![]()
![]() 固体全都转化为
固体全都转化为![]() ,则所用的
,则所用的![]() 溶液的物质的量浓度至少为______。
溶液的物质的量浓度至少为______。![]() 已知:常温下
已知:常温下![]() 、
、![]() 忽略溶液体积的变化
忽略溶液体积的变化![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)=C(石墨)![]() <0,可知,金刚石比石墨稳定
<0,可知,金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ![]() = -571.6kJ/mol
= -571.6kJ/mol
D.在稀溶液中,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是建造航空母舰的主体材料.
(1)航母升降机可由铝合金制造.
①铝元素在周期表中的位置为 ______ ![]() 工业用铝土矿冶炼铝的化学方程式 ______ .
工业用铝土矿冶炼铝的化学方程式 ______ .
②![]() 合金焊接前用NaOH溶液处理
合金焊接前用NaOH溶液处理![]() 膜,其化学方程式为 ______ .
膜,其化学方程式为 ______ .
(2)![]() 也是重要的铝盐,其无水
也是重要的铝盐,其无水![]() 升华
升华![]() 遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
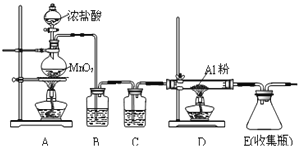
①装置在实验开始前应 ______ ,操作方法是: ______ .
②装置B中盛放饱和NaCl溶液,该装置的主要作用是 ______ ![]() 装置C中盛放 ______ .
装置C中盛放 ______ .
③装置A中发生的离子反应 ______ .
④该装置缺少尾气处理装置,尾气处理装置用的仪器是 ______ 装碱石灰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有NaCl杂质,有多种方法测定试样中纯碱的质量分数。
![]() 气体法
气体法
可用图中的装置进行实验:

主要实验步骤如下:
![]() 按图组装仪器,并检查装置的气密性;
按图组装仪器,并检查装置的气密性;
![]() 将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
![]() 从A处导管缓缓鼓入一定量的空气;
从A处导管缓缓鼓入一定量的空气;
![]() 称量盛有碱石灰的U型管的质量,得到b克;
称量盛有碱石灰的U型管的质量,得到b克;
![]() 从分液漏斗滴入
从分液漏斗滴入![]() 的盐酸,直到不再产生气体时为止;
的盐酸,直到不再产生气体时为止;
![]() 再从A处导管缓缓鼓入一定量的空气;
再从A处导管缓缓鼓入一定量的空气;
![]() 再次称量盛有碱石灰的U型管的质量,得到c克;
再次称量盛有碱石灰的U型管的质量,得到c克;
![]() 重复步骤
重复步骤![]() 和
和![]() 的操作,直到U型管的质量基本不变,为d克;
的操作,直到U型管的质量基本不变,为d克;
请填空和回答问题:
![]() 、D两装置中分别装什么试剂C: ______ D: ______
、D两装置中分别装什么试剂C: ______ D: ______
![]() 装置中干燥管F的作用是 ______
装置中干燥管F的作用是 ______
![]() 该试样中纯碱的质量分数的计算式为 ______
该试样中纯碱的质量分数的计算式为 ______
![]() 沉淀法
沉淀法
称取![]() 克样品完全溶于水后加足量的
克样品完全溶于水后加足量的![]() 溶液,然后过滤、洗涤、干燥称重得
溶液,然后过滤、洗涤、干燥称重得![]() 克固体,在该实验洗涤操作中如何检验固体已洗干净 ______ 。
克固体,在该实验洗涤操作中如何检验固体已洗干净 ______ 。
![]() 滴定法
滴定法
准确称取![]() 克样品,溶于水配成250mL溶液,量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用
克样品,溶于水配成250mL溶液,量取25.00mL溶液于锥形瓶中,加入几滴酚酞作指示剂,用![]() 的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,则样品中纯碱的质量分数为 ______ ,以下实验操作导致测量结果偏低的是 ______
的盐酸溶液进行滴定,到达终点时共消耗20.00mL盐酸,则样品中纯碱的质量分数为 ______ ,以下实验操作导致测量结果偏低的是 ______
A.配制样品溶液定容时俯视容量瓶刻度线
B.配制样品溶液定容后摇匀,发现液面低于容量瓶刻度线,于是又加水至刻度线
C.用盐酸滴定时滴定前仰视刻度线读数,滴定终点时俯视刻度线读数
D.滴定前锥形瓶中有水
E.酸式滴定管滴定前有气泡,而滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
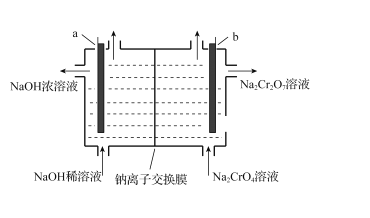
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。
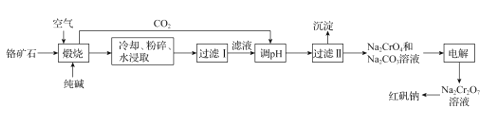
已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com