
黄铜矿(主要成分CuFeS2)是提取铜的主要原料
已知:2CuFeS2+4O2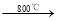 Cu2S+3SO2+2FeO?炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO?炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到 mol铜
15, 4.5 (每空3分)
【解析】
试题分析:①由6 mol CuFeS2生成6 mol Cu,则n(Cu2O)=2mol;n(Cu2S)=1mol;根据Cu元素守恒可知需要CuFeS2的物质的量是n(CuFeS2)=6mol;6mol的CuFeS2完全氧化变为3mol的Cu2S消耗O2的物质的量是12mol;产生的3mol的Cu2S中2mol的Cu2S氧化为2mol的Cu2O消耗3mol的O2;所以由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量是12mol+3mol=15mol;② 6 mol CuFeS2,发生第一个反应消耗12mol的O2;还有剩余的O2的物质的量是2.25 mol .根据第二个式子可知:3mol的O2会消耗2mol的Cu2S,则2.25 mol的O2会发生反应消耗Cu2S的物质的量是(2.25 mol÷3)×2=1. 5 mol。产生Cu2O1. 5 mol,还有Cu2S的物质的量是3mol—1. 5 mol =1. 5 mol ,根据方程式2Cu2O+Cu2S = 6Cu+SO2中两种物质的物质的量关系可知Cu2S过量,产生Cu的物质的量应该1. 5 mol×3=4.5 mol。
考点:考查物质的量有过量时的计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:计算题
(本题共14分)
多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得。不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙。
3Ca(OH)2+8S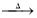 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S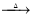 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
52.硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x = 。
53.取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解。原理如下: Sx2—+2H2O+2CO2→(x—1)S↓+H2S↑+2HCO3—;S2O32—+ H2O+CO2→HSO3—+HCO3—+S↓完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 。(答案用小数表示,保留2位有效数字)
54.如果把生石灰、硫磺和水按质量比7∶16∶70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 。
55.现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推理过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品——三聚氰酸,反应的化学方程式如下:
NH3 + CO2 →  + H2O
+ H2O
下列有关三聚氰酸的说法正确的是
A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:填空题
(8分)现有:①硫酸铜 ②碳酸钙固体 ③磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧苛性钾 ⑨NH3·H2O ⑩石灰水,其中属于强电解质的是 ,属于弱电解质的是 ,属于非电解质的是 ,既不是电解质,又不是非电解质的是 。(填序号)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:选择题
从海水中提取部分物质的过程如下图所示

下列有关说法错误的是
A.过程①需要加入化学试剂、沉淀、过滤等操作
B.由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C.工业上一般用金属钠与无水MgCl2反应制取Mg单质
D.反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:填空题
(17分)利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质。用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去得无色溶液。据此回答:

(1)仪器b的名称为 ,b中发生反应的离子方程式为 。
(2)如何检验A装置的气密性
(3)氯水长时间放置,pH将会
(4)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字补充:
①氯水与NaOH反应,碱性减弱红色褪去。② 。
(5)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
【实验步骤】
①取上述实验后试管内的无色溶液3 mL盛于另一支洁净的试管中;② ,振荡试管。
【现象与结论】
①若 ,则证明溶液红色褪去的原因是①而不是②。
②若 ,则证明溶液红色褪去的原因是②而不是①。
(6)为了从新制氯水中制得较高浓度的HClO,可向氯水中加入的试剂是 。
A.CaCO3 B.NaHSO3 C.饱和 NaCl溶液 D.Ca(OH)2
(7)有人提议本实验AB之间要加一个盛有饱和食盐水的除杂装置,你认为是否有必要(填“是”或“否”)______
(8)本实验有一明显的错误是,改正措施是
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
山梨酸是一种常见的食物添加剂,它是一种无色针状晶体或白色粉末,它的结构简式为CH3—CH=CH—CH=CH—COOH。下列关于山梨酸的叙述不正确的是
A.山梨酸易溶于乙醇
B.山梨酸能与氢气发生加成反应
C.山梨酸能和乙醇反应生成酯
D.1mol山梨酸能和金属钠反应生成1mol氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com