
| A. | 53% | B. | 46% | C. | 18% | D. | 36% |
科目:高中化学 来源: 题型:解答题
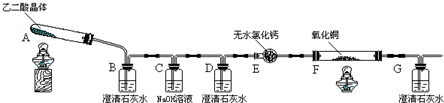
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
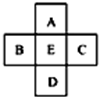
| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 油脂都是高级脂肪酸的甘油酯,是一种高热量营养素 | |
| C. | 人体需要的二十多种氨基酸,都可以通过人体自身合成 | |
| D. | 在一定条件下,它们都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
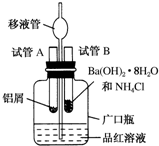 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com