
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
分析 A.相邻原子或离子之间强烈的相互作用是化学键;
B.非金属元素原子间可能形成离子键;
C.化学反应的实质是旧化学键的断裂和新化学键的形成;
D.化学键是相邻原子之间的相互作用力.
解答 解:A.相邻原子或离子之间强烈的相互作用是化学键,所以化学键可能是原子或离子间的作用力,故A正确;
B.非金属元素原子间可能形成离子键,如氯化铵属于离子化合物,非金属元素原子间形成离子键,故B错误;
C.化学反应的实质是旧化学键的断裂和新化学键的形成,则化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成,故C正确;
D.化学键是相邻原子之间的相互作用力,相互作用力包含吸引力和排斥力,故D正确;
故选B.
点评 本题考查了化学键的有关知识点,题目难度不大,知道化学键的概念、构成微粒是解本题关键,化学键包含金属键、离子键、共价键,但氢键不属于化学键,为易错点.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1•L-1的 Ca(ClO)2溶液中含ClO-数目小于2NA | |
| B. | 1 mo1 N2和3 mol H2在密闭容器中充分反应后,容器中含有 N-H键数为6NA | |
| C. | 1 mol乙烯和乙醇气体的混合物完全燃烧,消耗的氧分子数为3NA | |
| D. | 标准状况下,2.24 L35Cl2中含有的中子数为3.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
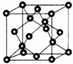 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>KCl>NaCl | D. | CaO>BaO>NaCl>KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
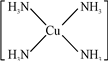 2+.
2+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com