
1.28g铜和一定量的浓硝酸反应,
(1)若反应生成的气体全部为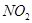 ,求消耗的
,求消耗的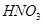 的物质的量。(3分)
的物质的量。(3分)
(2)若随着铜的不断减少,反应生成的气体的颜色也逐渐变浅。当铜全部反应时,共收集到标准状况下气体1.12L,求反应中消耗的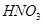 的物质的量。(3分)
的物质的量。(3分)
(6分)(1)0.08mol(2)0.09mol
【解析】
试题分析:(1)1.28g铜的物质的量是1.28g÷64g/mol=0.02mol
反应中失去0.02mol×2=0.04mol电子
硝酸的还原产物是NO2,得到1个电子
实验根据电子得失守恒可知,被还原的硝酸是0.04mol
又因为没有被还原的硝酸是0.02mol×2=0.04mol
所以消耗硝酸的物质的量是0.04mol+0.04mol=0.08mol
(2)根据题意可知生成的气体是NO和NO2的混合物
物质的量是1.12L÷22.4L/mol=0.05mol
则根据氮原子守恒可知,参加反应的硝酸的物质的量是0.05mol+0.04mol=0.09mol
考点:考查金属铜和硝酸反应的有关计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是在明确反应原理的基础上,灵活运用各种守恒法,即质量守恒定律、原子守恒、电荷守恒以及电子的得失守恒等,有利于培养学生的逻辑推理能力,提高学生的应试能力和学科素养。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2012-2013学年福建省漳州市康桥学校高一下学期期中考试化学试卷(带解析) 题型:计算题
1.28g铜和一定量的浓硝酸反应,
(1)若反应生成的气体全部为 ,求消耗的
,求消耗的 的物质的量。(3分)
的物质的量。(3分)
(2)若随着铜的不断减少,反应生成的气体的颜色也逐渐变浅。当铜全部反应时,共收集到标准状况下气体1.12L,求反应中消耗的 的物质的量。(3分)
的物质的量。(3分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com