
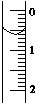
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
分析 Ⅰ.(1)根据量取液体体积的精确度以及液体的性质选择仪器;溶液的定容在对应体积的容量瓶中进行;
(2)醋酸与氢氧化钠溶液恰好反应时生成醋酸钠,溶液呈碱性,可用酚酞作指示剂;
(3)根据滴定管的结构与精确度来分析;
(4)滴定终点时溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅱ.(1)根据数据的合理性求出平均消耗的NaOH溶液的体积,然后根据白醋与NaOH 溶液反应的关系式:CH3COOOH~NaOH来解答;
(2)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:Ⅰ.(1)滴定管精确度为0.01ml,醋酸具有酸性能腐蚀橡胶管,所以应选用酸式滴定管量取白醋;用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液;
故答案为:酸式滴定管;容量瓶;
(2)由于醋酸钠溶液显示碱性,可用酚酞作指示剂,则用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞,
故答案为:酚酞;
(3)滴定管液面的读数0.60mL;
故答案为:0.60;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅱ.(1)第1次滴定误差明显大,属异常值,应舍去,3次消耗NaOH溶液的体积为:15.00mL、15.05mL、14.95mL,则NaOH溶液的平均体积为15.00mL;
设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 0.1000mol/L×0.015L×40g/mol
x=0.450
c(市售白醋)=$\frac{\frac{0.450g}{60g/mol}}{0.01L}$=0.75mol•L-1,样品总酸量$\frac{0.75×60}{10}$=4.50g•100mL-1;
故答案为:0.75;4.5;
(2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故a正确;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故b正确;
c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)不变,故c错误;
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故d错误;
故选:ab.
点评 本题主要考查了中和滴定操作,难度不大,只要掌握对应知识即可完成,注意根据浓度公式分析误差.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结 论 |
| A | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 盐酸的酸性强于碳酸,故;氯的非金属性比碳强 |
| B | 在0.1mol•L-1的NaHCO3溶液中加2滴酚酞,微热 | 溶液颜色由浅红色逐渐加深 | 盐类的水解反应是吸热反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨气呈碱性 |
| D | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 钢钉表面有白色沉淀 | B. | 实验2中的高锰酸钾溶液先变色 | ||
| C. | 负极的电极反应为:Fe-3e-→Fe3+ | D. | 铁钉表面有红褐色物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
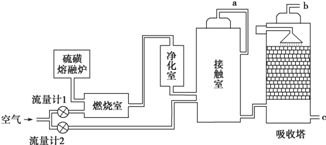
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
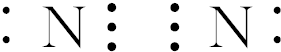 ,
, ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(甲):c(乙)=1:10 | B. | c(H+)甲:c(H+)乙=1:2 | ||
| C. | c(OH-)甲:c(OH-)乙=10:1 | D. | a(甲):a(乙)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com