
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
分析 甲烷碱性燃料电池中,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据电极反应式知,X为负极、Y为正极,电池反应式为CH4+2OH-+2O2=CO32-+3H2O,据此分析解答.
解答 解:甲烷碱性燃料电池中,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据电极反应式知,X为负极、Y为正极,电池反应式为CH4+2OH-+2O2=CO32-+3H2O,
A、根据CH4+10OH--8e-=CO32-+7H2O知,通入甲烷的电极是负极,即X为负极,Y为正极,故A正确;
B、该电池工作时,X极是负极,根据电极反应:CH4+10OH--8e-=CO32-+7H2O,该电极附近溶液的碱性减弱,故B错误;
C、标况下,5.6L氧气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,转移电子物质的量=0.25mol×4=1mol,所以有1mol电子转移,故C正确;
D、根据正极和负极反应得到总反应为:CH4+2O2+2OH-=CO32-+3H2O,工作一段时间后,KOH的物质的量减少,故D正确.
故选B.
点评 本题考查了燃料电池,明确得失电子与正负极的关系是解本题关键,能正确书写电池反应式并据此进行计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 8 | 1s22s22p4 | 2s22p4 | 第二周期 | ⅥA |
| 24 | 1s22s22p63s23p63d54s1 | 3d54s1 | 第四周期 | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 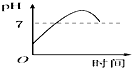 | B. | 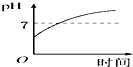 | C. | 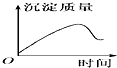 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O.草酸钙和草酸氢钙均为白色不溶物 |
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
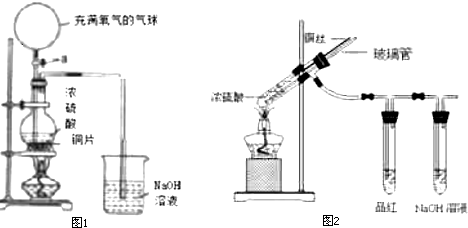
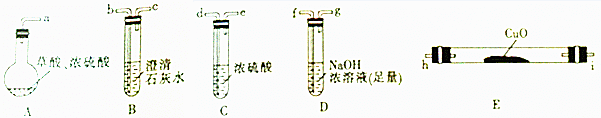
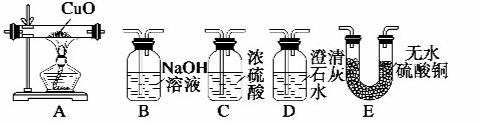
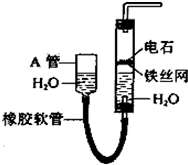 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
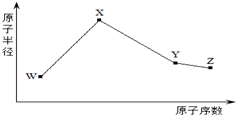 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ②③⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com