
分析 (1)反应2FeCl3+Cu═2FeCl2+CuCl2中,Fe元素化合价降低,被还原,FeCl3为氧化剂,Cu元素化合价升高,被氧化,Cu为还原剂;
(2)根据方程式和转移电子的量来计算;
(3)根据离子方程式的书写方法来回答,三种盐均为易溶于水的强电解质,要写成离子;
(4)铁元素化合价+2价升高为+3价,过氧化氢中氧元素化合价-1价变化为-2价,电子转移总数2e-,结合原子守恒和原子守恒配平书写;
(5)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算.
解答 解:(1)化合价升高元素是Cu,失电子,化合价降低元素是Fe,得到电子,化合价升高数=化合价降低数=转移电子数=2,双线桥法表示电子转移的方向和数目如下: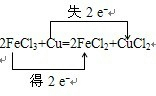 ,
,
故答案为: ;
;
(2)根据方程式当有2mol电子发生转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,
故答案为:9.6g;
(3)反应2FeCl3+Cu=2FeCl2+CuCl2改为离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)铁元素化合价+2价升高为+3价,过氧化氢中氧元素化合价-1价变化为-2价,电子转移总数2e-,结合原子守恒和原子守恒配平书写得到化学方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O,
故答案为:2、1、2、2、2;
(5)Br元素化合价升高,Mn元素化合价降低,反应中KMnO4为氧化剂,MnBr2为还原产物,HBr为还原剂,Br2为氧化产物;Br元素化合价升高1价,Mn元素化合价降低5价,反应中转移10个电子,则用双线桥标出该反应的电子转移方向和数目为 ;被氧化的HBr占总的参加反应的HBr的$\frac{5}{8}$,则被氧化的还原剂的质量是$\frac{5}{8}$×64.8g=40.5g;
;被氧化的HBr占总的参加反应的HBr的$\frac{5}{8}$,则被氧化的还原剂的质量是$\frac{5}{8}$×64.8g=40.5g;
故答案为:40.5.
点评 本题综合考查氧化还原反应的概念和计算、以及离子方程式的书写,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度分析氧化还原反应的相关概念和物质的性质,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
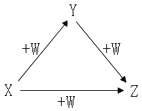 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
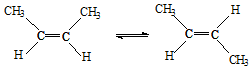 △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 | |
| B. | 顺-2-丁烯比反-2-丁烯更稳定 | |
| C. | 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯的核磁共振氢谱都有两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2和CO2常温都是气体分子 | |
| B. | CO2、SiO2均能和氢氟酸反应 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | CO2、SiO2分别是H2CO3、H2SiO3的酸酐,因而均可由CO2、SiO2与水反应制得相应酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉可用于酿酒 | |
| B. | 13g苯中含C-H键的数目是NA | |
| C. | 1mol的金刚石中含4NA根C-C键 | |
| D. | 标准状况下,11.2L甲烷和乙烯的混合物含氢原子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com