
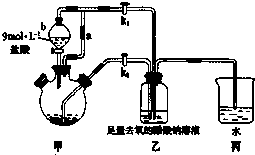
 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).分析 工作原理是:先在装置甲中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价.因此在装置甲中,要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气.反应开始前,应该先打开K1让氢气充满整个装置,然后再关闭K1,打开K2,利用生成的氢气将装置甲中的二价铬离子压入装置乙中,跟醋酸钠反应生成醋酸亚铬水合物,装置丙的作用是:可以防止空气进入装置乙.
(1)用锌将三价铬还原为二价,再与醋酸钠溶液作用制得[Cr(CH3COO)2]2•2H2O,配平书写离子方程式;
(2)由仪器的结构特征,可知仪器b是分液漏斗;导管a平衡压强,有利于分液漏斗内的液体顺利滴下;
(3)关闭K1,打开K2,利用生成的氢气将装置甲中的二价铬离子压入装置乙中;
(4)可以防止空气进入装置乙;
(5)甲中制备亚铁盐,并用氢气排尽装置内空气,乙中盛放氢氧化钠;
(6)根据Cr原子守恒计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率;
(7)由电离平衡常数可知,三氯乙酸的酸性比乙酸的酸性强,可以测定相同浓度的pH验证.
解答 解:工作原理是:先在装置甲中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价.因此在装置甲中,要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气.反应开始前,应该先打开K1让氢气充满整个装置,然后再关闭K1,打开K2,利用生成的氢气将装置甲中的二价铬离子压入装置乙中,跟醋酸钠反应生成醋酸亚铬水合物,装置丙的作用是:可以防止空气进入装置乙.
(1)用锌将三价铬还原为二价,再与醋酸钠溶液作用制得[Cr(CH3COO)2]2•2H2O,反应离子方程式为:2Cr3++Zn+4CH3COO-+2H2O═Zn2++[Cr(CH3COO)2]2•2H2O,
故答案为:2Cr3++Zn+4CH3COO-+2H2O═Zn2++[Cr(CH3COO)2]2•2H2O;
(2)由仪器的结构特征,可知仪器b是分液漏斗;导管a平衡压强,有利于分液漏斗内的液体顺利滴下、并导气,
故答案为:分液漏斗;平衡压强,有利于分液漏斗内的液体顺利滴下、并导气;
(3)关闭K1,打开K2,利用生成的氢气将装置甲中的二价铬离子压入装置乙中,
故答案为:关闭K1,打开K2;
(4)装置丙中导管口水封,可以防止空气进入装置乙中氧化Cr2+,
故答案为:防止空气进入装置乙中氧化Cr2+;
(5)甲中制备亚铁盐,并用氢气排尽装置内空气,再将亚铁盐压入乙中反应生成氢氧化亚铁,乙中盛放氢氧化钠溶液,
故答案为:NaOH;
(6)根据Cr原子守恒,[Cr(CH3COO)2]2•2H2O的质量为0.05L×1.2mol/L×$\frac{1}{2}$×376g/mol=11.28g,所得产品的产率为$\frac{9.4g}{11.28g}$=33.3%,
故答案为:83.3%;
(7)由电离平衡常数可知,三氯乙酸的酸性比乙酸的酸性强,证明三氯乙酸、乙酸的酸性强弱的实验方案为:分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸,
故答案为:分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
点评 本题考查了物质制备实验,涉及化学仪器识别、对操作与装置的分析评价、实验方案设计等,关键是明确反应原理与各装置作用,注意对题目信息的应用,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
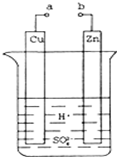 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
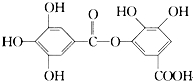
| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 在一定条件下,1 mol该物质最多能和4 mol Br2反应 | |
| C. | 它可以水解,水解产物为两种有机物 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
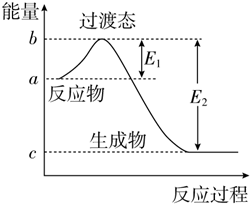 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
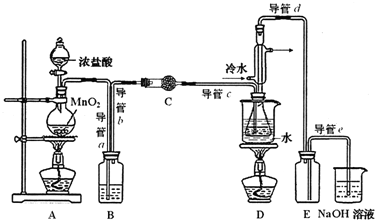
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2C12 | -76 | 138 | 1.75 | 与水反应 |
| C S2 | -109 | 47 | 1.26 | 不溶于水 |
| CC14 | -23 | 77 | 1.59 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
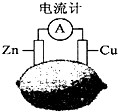
| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
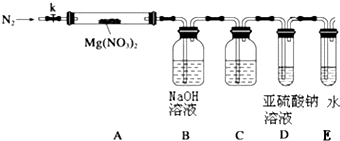 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com