
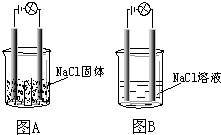
 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 在NaCl溶液中,水电离出了大量的离子 |
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g水中含有的水分子数是2NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 常温常压下,1molCH4的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH(OH)CH2OU和CH3CH(Cl)CH2CH3都是手性分子 | |
| B. | NH4+与H3O+的空间构型相似 | |
| C. | BF3与苯都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硫酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| D. | 某溶液中先滴加足量稀盐酸,无明显变化,再滴加少量BaCl2溶液,生成白色沉淀,证明该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2υ(NO)=3υ(H2O) | B. | 5υ(O2)=6υ(H2O) | C. | υ(NH3)=υ(H20) | D. | 5υ(NH3)=4υ(O2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com