
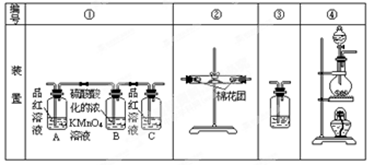
| A��Ba(NO3)2 | B��BaCl2 | C��Ba(OH)2 | D������NH3��BaCl2��Һ |

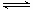 Fe2+(aq)+S2-(aq) ,����Ksp(FeS)��6.3��10��18mol2��L��2>>Ksp(CuS)��1.3��10��36mol2��L��2�����Ե���Һ�к���Cu2+ʱ��Cu2+�ͻ���FeS���������S2-��ϲ��������ܵij���CuS��Cu2++ S2-=CuS����FeS���ܽ���룬������S2-�ٷ�Ӧ��ΪCuS�����������ܹ�����Һ�е�Cu2+��ȫ������ȥ����Ӧ�����ַ���ʽΪ����FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+( aq). �� SO2+H2O=H2SO3,��Һ�����ԡ�A���������м���Ba(NO3)2ʱ��Ҳ���൱�ڴ������ᡣ������ǿ�����ԣ��ܰ�H2SO3��������H2SO4.�ʻ����BaSO4��������ȷ��B����������BaCl2������Ӧ����Ӧ�ķ���ʽΪ��B��BaCl2+ SO2+H2O=BaSO3��+2HCl. BaSO3����HCl������Ӧ�����������Ի��������ڡ����÷�Ӧ�Dz��ܷ����ġ����仰˵���Dz��ܷ�����Ӧ����������C������������SO2��������Ӧ��Ba(OH)2+ SO2=BaSO3��+ H2O.��ȷ��D�����ȷ�����Ӧ��2NH3+ SO2+H2O= (NH4)2SO3,Ȼ������(NH4)2SO3+BaCl2= BaSO3��+ 2NH4Cl .��ȷ�����ѡ��ΪA��C��D��������SO2���������Է�Ӧ�ķ���ʽΪ��SO2+NaOH=NaHSO3��NaHSO3=Na++HSO3-��HSO3-����Һ�д��ڵ���ƽ��HSO3-
Fe2+(aq)+S2-(aq) ,����Ksp(FeS)��6.3��10��18mol2��L��2>>Ksp(CuS)��1.3��10��36mol2��L��2�����Ե���Һ�к���Cu2+ʱ��Cu2+�ͻ���FeS���������S2-��ϲ��������ܵij���CuS��Cu2++ S2-=CuS����FeS���ܽ���룬������S2-�ٷ�Ӧ��ΪCuS�����������ܹ�����Һ�е�Cu2+��ȫ������ȥ����Ӧ�����ַ���ʽΪ����FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+( aq). �� SO2+H2O=H2SO3,��Һ�����ԡ�A���������м���Ba(NO3)2ʱ��Ҳ���൱�ڴ������ᡣ������ǿ�����ԣ��ܰ�H2SO3��������H2SO4.�ʻ����BaSO4��������ȷ��B����������BaCl2������Ӧ����Ӧ�ķ���ʽΪ��B��BaCl2+ SO2+H2O=BaSO3��+2HCl. BaSO3����HCl������Ӧ�����������Ի��������ڡ����÷�Ӧ�Dz��ܷ����ġ����仰˵���Dz��ܷ�����Ӧ����������C������������SO2��������Ӧ��Ba(OH)2+ SO2=BaSO3��+ H2O.��ȷ��D�����ȷ�����Ӧ��2NH3+ SO2+H2O= (NH4)2SO3,Ȼ������(NH4)2SO3+BaCl2= BaSO3��+ 2NH4Cl .��ȷ�����ѡ��ΪA��C��D��������SO2���������Է�Ӧ�ķ���ʽΪ��SO2+NaOH=NaHSO3��NaHSO3=Na++HSO3-��HSO3-����Һ�д��ڵ���ƽ��HSO3-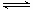 H++SO32-��ˮ��ƽ��HSO3-+ H2O
H++SO32-��ˮ��ƽ��HSO3-+ H2O 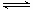 H2SO3+OH-������ʹ��Һ�����ԣ�ˮ��ʹ��Һ�Լ��ԡ���Ϊ������Һ�����ԣ����Ե������ˮ�⡣c (H+)>c(OH-).����Һ�г��˴���ˮ��ƽ�������H2O
H2SO3+OH-������ʹ��Һ�����ԣ�ˮ��ʹ��Һ�Լ��ԡ���Ϊ������Һ�����ԣ����Ե������ˮ�⡣c (H+)>c(OH-).����Һ�г��˴���ˮ��ƽ�������H2O 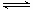 H++OH-��SO32-ֻ��HSO3-�������������c (H+)>c(SO32-)������ʵĵ���̶ȣ�HSO3-> H2O�����c(SO32-)> c(OH-)������HSO3-�ǵ��뻹��ˮ�ⶼҪ���ģ�����c(Na+)>c(HSO3-).�����Һ�и������ӵ�Ũ�ȹ�ϵΪ��c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)��(2) �����缫���һ��ʱ��� Fe(OH)3�������ɣ�˵��Fe���Դ�����������ӣ�������,������������ԭ��Ӧ��Fe-2e-=Fe2+.������Fe2+�л�ԭ�ԣ��ܽ���Һ��Cr2O72����ԭΪCr3+�����߷����ķ�ӦΪ��Cr2O72����6Fe2+��14H+ ��2Cr3+��6Fe3+��7H2O��Cr3+��Fe3+ˮ�����Cr(OH)3��Fe(OH)3�������Ӷ����Խ��ͷ�ˮ�и�Ԫ�صĺ�������������ʯī�缫����缫�������μӷ�Ӧ������Һ�е�Cl-ʧȥ���ӡ���������������Cl2���Ͳ��ܽ�Cr2O72����ԭΪCr3+����3������Ƴɼ���ȼ�ϵ�أ�������X�����ֱ���ŷŵ������С���XΪN2,a�缫���������缫��ӦΪ2NH3+6OH����6e�� =N2+6H2O��ͨ������ĵ缫Ϊ������������Ӧ��O2+4e-+2H2O=4OH-��NH3��H2O
H++OH-��SO32-ֻ��HSO3-�������������c (H+)>c(SO32-)������ʵĵ���̶ȣ�HSO3-> H2O�����c(SO32-)> c(OH-)������HSO3-�ǵ��뻹��ˮ�ⶼҪ���ģ�����c(Na+)>c(HSO3-).�����Һ�и������ӵ�Ũ�ȹ�ϵΪ��c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)��(2) �����缫���һ��ʱ��� Fe(OH)3�������ɣ�˵��Fe���Դ�����������ӣ�������,������������ԭ��Ӧ��Fe-2e-=Fe2+.������Fe2+�л�ԭ�ԣ��ܽ���Һ��Cr2O72����ԭΪCr3+�����߷����ķ�ӦΪ��Cr2O72����6Fe2+��14H+ ��2Cr3+��6Fe3+��7H2O��Cr3+��Fe3+ˮ�����Cr(OH)3��Fe(OH)3�������Ӷ����Խ��ͷ�ˮ�и�Ԫ�صĺ�������������ʯī�缫����缫�������μӷ�Ӧ������Һ�е�Cl-ʧȥ���ӡ���������������Cl2���Ͳ��ܽ�Cr2O72����ԭΪCr3+����3������Ƴɼ���ȼ�ϵ�أ�������X�����ֱ���ŷŵ������С���XΪN2,a�缫���������缫��ӦΪ2NH3+6OH����6e�� =N2+6H2O��ͨ������ĵ缫Ϊ������������Ӧ��O2+4e-+2H2O=4OH-��NH3��H2O 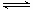 NH4++OH-��
NH4++OH-�� 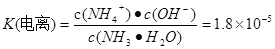 - NH4++ H2O
- NH4++ H2O 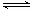 H+ + NH3��H2O,
H+ + NH3��H2O, 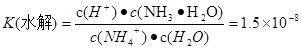 .����ʽ��ˣ��ɵ�
.����ʽ��ˣ��ɵ� ��c (H+)��c(OH-)=K(����) ��K(ˮ��) ��c(H2O)="Kw." �����ڸ��¶���ˮ�����ӻ�����Kw=2.7��10-13.ˮ��������ʣ������¶ȣ��ٽ�ˮ�ĵ��룬ˮ�������������Ũ������ˮ�����ӻ�����Ҳ��������2.7��10-13>1.0��10-14.�����¶ȸ���25�档2�ij�ȥ����������Cr2O72�������Է�ˮ�ĵ�ⷨ������ԭ��صķ�Ӧԭ�����缫ʽ����д��������ʵĵ���ƽ�⡢�ε�ˮ��ƽ�⡢ˮ�����ӻ������ļ����֪ʶ��
��c (H+)��c(OH-)=K(����) ��K(ˮ��) ��c(H2O)="Kw." �����ڸ��¶���ˮ�����ӻ�����Kw=2.7��10-13.ˮ��������ʣ������¶ȣ��ٽ�ˮ�ĵ��룬ˮ�������������Ũ������ˮ�����ӻ�����Ҳ��������2.7��10-13>1.0��10-14.�����¶ȸ���25�档2�ij�ȥ����������Cr2O72�������Է�ˮ�ĵ�ⷨ������ԭ��صķ�Ӧԭ�����缫ʽ����д��������ʵĵ���ƽ�⡢�ε�ˮ��ƽ�⡢ˮ�����ӻ������ļ����֪ʶ��

 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
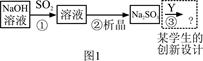
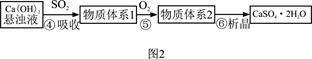
| �� �� | Ca(OH)2 | NaOH |
| �۸�Ԫ/kg�� | 0.36 | 2.9 |
| ����SO2�ijɱ���Ԫ/mol�� | 0.027 | 0.232 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
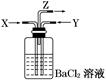
| A��ϴ��ƿ�в����ij�����̼�ᱵ |
| B����Z���ܳ�����������������̼ |
| C��ϴ��ƿ�в����ij����������ᱵ��̼�ᱵ |
| D����Z���ܵij��ڴ����к���ɫ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
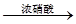 H2SO4
H2SO4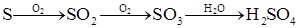
| A��;���ٷ�Ӧ��������Ũ�����ǿ�����Ժ����� |
| B��;���ڵĵڶ�����Ӧ��ʵ�������п���ͨ������O2Ũ�������ͳɱ� |
| C����;���ٺ͢ڷֱ���ȡ1 mol H2SO4�������ϸ�����1 mol S����ת��6 mol e- |
| D��;������;������ȸ������֡���ɫ��ѧ������������Ϊ;���ڱ�;������Ⱦ���С��ԭ�������ʸ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Ũ���������ˮ�ԣ������ʹ����̼�� |
| B����SO2ͨ��Ʒ����Һ����Һ��ɫ����Ȼָ�ԭɫ����SO2ͨ����ˮ����ˮ��ɫ�����Ҳ�ָܻ�ԭɫ |
| C���ڷ�ӦSO2+2H2S=3S+2H2O��SO2�������� |
| D������ڹ����Ĵ�����ȼ�տ�������SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��SO2+H2O H2SO3 H2SO3 |
| B��SO2+2NaOH=Na2SO3+H2O |
C��2SO2+O2 2SO3 2SO3 |
| D��SO2+CaO=CaSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����0��45 mol | B������0��45 mol |
| C����0��45 mol��0��9 mol֮�� | D������0��9 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

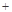 O2
O2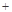 2H2SO4=2CuSO4
2H2SO4=2CuSO4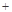 2H2O��
2H2O��| A�������;���١��ۣ�;���ڸ��õ���������ɫ��ѧ˼�� |
| B��;�����У�1mol Cu������Ũ���ᷴӦ�����64g SO2���� |
C��;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ |
D��1mol Cu�ֱ���;���ڡ����У�����ԭ��H2SO4������֮��Ϊ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com