
分析 MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2;得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化;该反应中氧化剂是二氧化锰、有一半的HCl作还原剂;由此分析解答.
解答 解:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2;氧化剂是 MnO2,还原剂是 HCl(浓),氧化产物是Cl2,还原产物是MnCl2,该反应中氧化剂是二氧化锰、有一半的HCl作还原剂,所以氧化剂和还原剂的物质的量之比为1:2,故答案为:MnO2;HCl(浓);Cl2;MnCl2;1:2.
点评 本题考查氧化还原反应概念及计算,为高频考点,侧重考查基本概念、基本计算,明确元素化合价变化与概念之间关系是解本题关键,注意:该反应中有一半盐酸作还原剂,一半盐酸体现酸性.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钡有两性 | |
| B. | 两支试管的白色沉淀均为亚硫酸钡 | |
| C. | SO2既有还原性,又是酸性氧化物 | |
| D. | 溶液的碱性增强,增大SO2在水溶液中的溶解度,使SO32-浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照条件下反应 | B. | 甲苯与液溴在铁催化作用下反应 | ||
| C. | 乙酸乙酯在碱性条件下水解 | D. | 乙醇制备乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
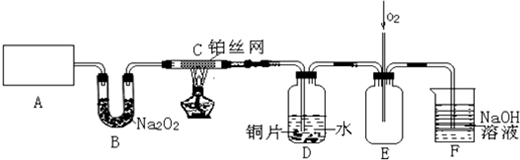
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Po-218和Po-210在元素周期表中的位置相同 | |
| B. | Po-218和Po-210中子数相同,互称为同位素 | |
| C. | Po-218和Po-210核外电子数肯定不相等 | |
| D. | Po-218和Po-210的质量数不同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
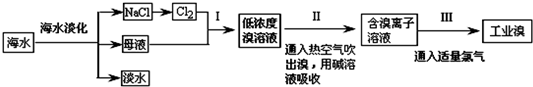
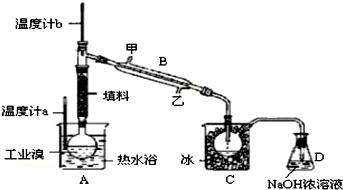
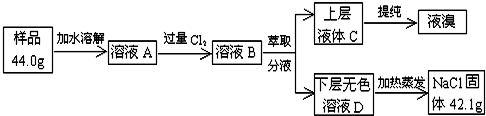
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com