
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是
A. 钠是银白色金属,熔点低,硬度大
B. 加热时,金属钠剧烈燃烧,产生黄色火焰
C. 钠与氧气反应时,产物是由O2的用量决定的
D. 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。发展“一碳化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“一碳化学”途径制取乙二醇的过程:
(1)在容积为2L的密闭容器中,由CO和H2合成乙醇的反应为
2CO(g)+ 4H2(g)![]() CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
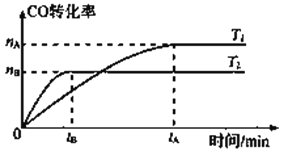
①根据上图可推知该反应ΔH_________0(填“>”、“<”或“=”)。
②该反应的平衡常数表达式为____________,降低温度平衡常数将_____(填“变大”、“变小”或“不变”)。
③下列说法中能判断该反应达到化学平衡状态的是_________(选填编号)。
a.容器中的压强不变 b.混合气体的密度不再变化
c.v正(CO)=2v逆(H2O) d.混合气体的平均相对分子质量不再变化
(2)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①用离子方程式解释KHC2O4溶液显酸性的原因:_______________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是________(填序号)。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
(3)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式______________________________。以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸B.用pH计测得某稀盐酸的pH为1.54
C.用25mL碱式滴定管量取出15.00mLKMnO4溶液D.用托盘天平称得某物质的质量为13.15g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式 S(s)+O2(g)=SO2(g) ΔH=-297.23 kJ·mol-1,说法正确的是
A.该反应是吸热反应
B.S 与 O2 反应的反应热是 297.23 kJ
C.1molSO2(g)的总能量小于 1molS(s)和 1molO2(g)能量总和
D.1molSO2(g)的总能量大于 1molS(s)和 1molO2(g)能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______.
已知:K1000℃>K800℃,则该反应是_________反应。(填“吸热”或“放热”);
(2)已知在800 ℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2 = ______________ ,反应CO2(g)+H2(g)
CO2(g)+H2(g)的平衡常数K2 = ______________ ,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K3 =_______________ 。
CO(g)+H2O(g)的平衡常数K3 =_______________ 。
(3)能判断该反应是否达到化学平衡状态的依据是_____________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为_____________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2(g)完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4(g)完全燃烧生成液态水和CO2气体,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1902年德国化学家哈伯研究出合成氨的方法.
(1)某温度时,N2与H2反应(可逆反应)过程中的能量变化如图1所示. 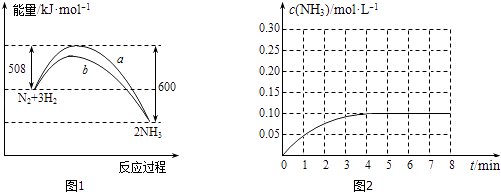
①写出合成氨的热化学方程式 .
②下列叙述正确的是 .
A.b曲线是加入催化剂时的能量变化曲线
B.在密闭容器中加入28gN2、6gH2 , 充分反应放出的热量小于92kJ
C.由图可知,断开1molN≡N键与3molH﹣H键吸收的能量和小于形成6molN﹣氮氢键所放出的能量
D.反应物的总能量低于生成物的能量
(2)在一容积为4L的密闭容器中,加入0.4molN2和1.2molH2 , 在一定条件下发生反应,反应中NH3的物质的量浓度变化情况如图2所示.据图计算从反应开始到平衡时,平均反应速率(H2)为mol/(Lmin),平衡时,c(N2)为 .
(3)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.若用 ![]() 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是(填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是(填字母序号). 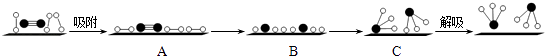
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com