
【题目】已知草酸为二元弱酸H2C2O4![]() HC2O4-+H+,Ka1;HC2O4-
HC2O4-+H+,Ka1;HC2O4-![]() C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4)
B. pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
【答案】C
【解析】试题分析:A、pH=1.2时,H2C2O4、HC2O4-的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c(HC2O4-),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),故A正确;B、由图象可知pH=1.2时,c(HC2O4-)=c(H2C2O4),则Ka1=c(H+)=10-1.2,pH=4.2时,c(HC2O4-)=c(C2O42-),Ka2=c(H+)=10-4.2,由电离常数可知![]() =
=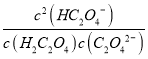 =1000,故B正确;C、将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故C错误;D、向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故D正确;故选C。
=1000,故B正确;C、将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故C错误;D、向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法中,不正确的是( )
A. 硅酸钠可用于制备硅胶和木材防火剂等
B. 氧化铝熔点高可用作耐火材料
C. 晶体硅可用于制造光导纤维
D. 漂白粉和臭氧可用于自来水消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是

A.30min时降低温度,40min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8min前A的平均反应速率为0.08mol/(Lmin)
D.30min~40min间该反应使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确
的是_________(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=______________________
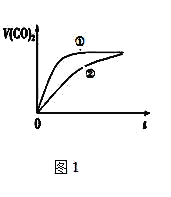
⑶常温下,将20mL 0.1 mol/L CH3COOH溶液 和20mL 0.1 mol/L HNO2 溶液分别与 20mL 0.1 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是_______(填写序号);反应结束后所得两溶液中,c(CH3COO-)________c(NO2-)(填“>”、“<”或“=”);
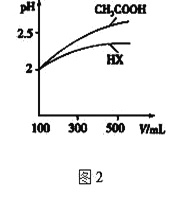
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数_________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A. 硫元素被氧化
B. 氧化剂与还原剂的物质的量之比为1:2
C. 每生成1molNa2S2O3,转移4mol电子
D. 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A、 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B、常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1mol Cl2与足量NaOH溶液反应转移的电子数NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子中所有原子都在同一平面上的一组是
A. NO2-和NH4+ B. H3O+和ClO3- C. NO3-和CO32- D. PO43-和SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com