
| A. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.漏掉硫酸根离子与钡离子反应;
B.不符合反应客观事实;
C.次氯酸为弱电解质,不能拆;
D.二者反应生成氢氧化铝沉淀和氯化铵.
解答 解:A.硫酸与氢氧化钡溶液反应,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.稀H2SO4与铁粉反应,离子方程式:Fe+2H+═Fe2++2H2↑,故B错误;
C.氯气通入水中,离子方程式:Cl2+H2O?H++Cl-+HClO,故C错误;
D.AlCl3溶液中加入足量的氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确离子方程式书写方法及反应实质是解题关键,注意化学式拆分、注意离子反应遵循客观事实,遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.30mol/l | B. | 0.225mol/l | C. | 0.45mol/l | D. | 0.36mol/l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水不可制取金属钠 | |
| B. | 钠与氧气反应的产物与反应条件有关 | |
| C. | 过氧化钠与水反应不能生成氢氧化钠 | |
| D. | 钠可以从四氯化钛中置换出钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 垃圾是放错地方的资源,应分类回收利用 | |
| B. | 实现化石燃料清洁利用,就无需开发新能源 | |
| C. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| D. | 将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器中CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 | |
| B. | v正(CO2)=v逆(H2O) | |
| C. | 容器内混合气体密度保持不变 | |
| D. | 3molH-H键断裂同时断裂3molH-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$I | |
| C. | S2-的结构示意图: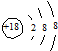 | |
| D. | 乙烯的结构简式:CH2═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
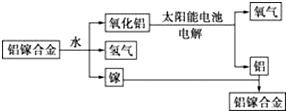 )
)| A. | 该过程中,能量的转化形式只有两种 | |
| B. | 铝镓合金可以循环使用 | |
| C. | 铝镓合金与水反应的化学方程式为2Al+3H2O═Al2O3+3H2↑ | |
| D. | 总反应式为2H2O═2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
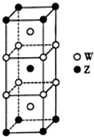 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.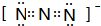 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com