
.证明溶液中是否有Fe2+,其操作正确的顺序是
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 7cV |
| 125a |
| 7cV |
| 125a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
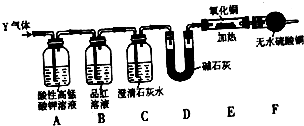
 Ⅰ掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
Ⅰ掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源:2013届天津市十二校高三第二次模拟联考化学试卷(带解析) 题型:实验题
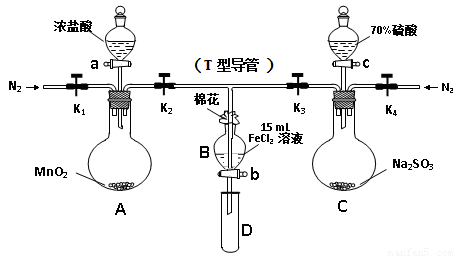
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。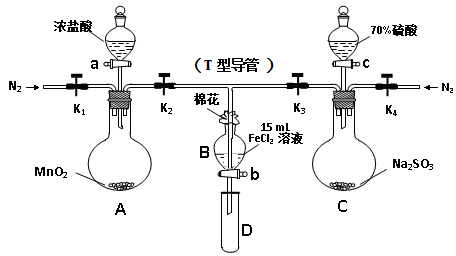
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中, 继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A。
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3。
Ⅵ.更新试管D,重复过程Ⅳ。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)能说明氧化性Fe3+ > SO2的离子方程式是 。
(5)过程Ⅵ,检验B溶液中是否含有SO42-的操作是 。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果不能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”),请用必要的文字说明理由 。
| | 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有 Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有SO42- |
 FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:实验题
海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
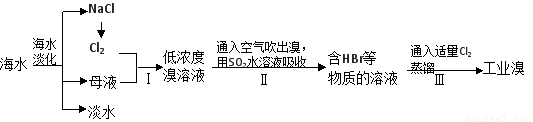
(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

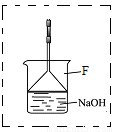
下表为苯、溴和溴苯的相关数据:
| 苯 | 溴 | 溴苯 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
回答下列问题:
(4)在A中加入30 .0mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①在该实验中, B装置的名称是__________,A的容积最适合的是_________(填编号)
a.25mL????? b.50mL????? c.100mL??? d.250mL
②收集溴苯时,应根据_________(填“C1”或“C2”)所显示的温度,其温度应为_________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有_______________________(填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案__________(填“合理”或“不合理”),理由是__________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市十二校高三第二次模拟联考化学试卷(解析版) 题型:实验题
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中, 继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A。
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3。
Ⅵ.更新试管D,重复过程Ⅳ。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)能说明氧化性Fe3+ > SO2的离子方程式是 。
(5)过程Ⅵ,检验B溶液中是否含有SO42-的操作是 。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果不能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”),请用必要的文字说明理由 。
|
|
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
|
甲 |
有Fe3+无Fe2+ |
有 Fe2+ |
|
乙 |
既有Fe3+又有Fe2+ |
有SO42- |
|
丙 |
有Fe3+无Fe2+ |
有SO42- |
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料: Fe2+(aq)+
SO32- (aq) 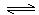 FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:

① 溶液E和F分别为 、 (写化学式)。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com