
| A. | $\frac{1}{8}$ | B. | $\frac{3}{8}$ | C. | $\frac{1}{4}$ | D. | $\frac{3}{4}$ |
分析 假定的NO和O2体积分别为V,NO、O2与水发生反应4NO+3O2+2H2O=4HNO3,据此计算判断剩余气体及剩余气体的体积,据此解答.
解答 解:假定的NO和O2体积分别为V,则:
4NO+3O2+2H2O=4HNO3,
4 3
V $\frac{3}{4}$V
故氧气剩余,剩余氧气为V-$\frac{3}{4}$V=$\frac{1}{4}$V,
所以充分反应后剩余气体的体积缩小为原体积的$\frac{\frac{1}{4}V}{2V}$=$\frac{1}{8}$,
故选A.
点评 本题以一氧化氮和二氧化氮为载体考查了化学方程式的有关计算,难度不大,假设法是解化学题的常用方法,注意运用假设法解答即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若保持温度,保持容器容积固定不变,向容器内补充B气体,则有a<b | |
| B. | 若保持温度、压强不变,充入惰性气体,则有a>b | |
| C. | 若其他条件不变,升高温度,则有a<b | |
| D. | 若a=b,则可能是在该温度下,保持容器容积固定不变情况下充入了惰性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | SiO2不与水反应,所以二氧化硅不是酸性氧化物 | |
| C. | 装有烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱与二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 | |
| D. | 晶体硅是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
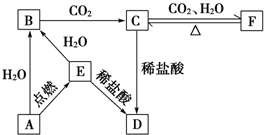
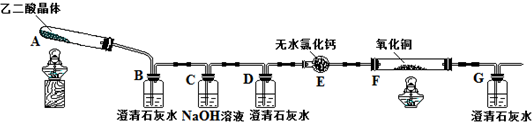
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A和B均可以是稀硫酸或NaOH溶液 | |
| B. | 若溶液B选用浓硝酸,则测得铜的质量分数偏大 | |
| C. | 溶液A和B均不可选用浓硝酸 | |
| D. | 实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
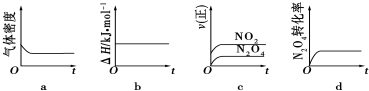
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com