
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
A、SO2为0.4mol/L、O2为0.2mol/L B、SO2、SO3均为0.15mol/L
C、SO2为0.25mol/L D、SO3为0.4mol/L
C
【解析】
试题分析:化学平衡研究的对象为可逆反应,化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析。A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;B、反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故B不正确; C、SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,该题中实际变化为0.05mol/L,小于0.2mol/L,故C周期;D、SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故D错误;故选C。
考点:考查考查了化学平衡的建立


科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
下列关于F、Cl、Br、I的比较,说法正确的是
A.原子最外层的电子数随核电荷数的增加而增多
B.简单阴离子的还原性随核电荷数的增加而增强
C.氢化物的稳定性随核电荷数的增加而增强
D.非金属性随核电荷数的增加而增强
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
下列离子方程式或化学方程式书写正确的是 ( )
A.实验室用氯化铵与消石灰制氨气 NH4++OH- NH3↑+H2O
NH3↑+H2O
B.将CO2通入BaCl2溶液中 H2O +CO2+Ba2+ =BaCO3↓+2H+
C.少量SO2通入加漂白粉的水溶液中 SO2+H2O+Ca2++3ClO- = CaSO4↓+2HClO+Cl-
D.用H2还原MgO H2+MgO  Mg+H2O
Mg+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高二下学期期中联考化学试卷(解析版) 题型:选择题
氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2。大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化如图所示,则下列叙述正确的是( )。
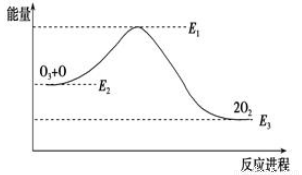
①反应O3+O=2O2的ΔH=E1-E3 ②反应O3+O=2O2是放热反应 ③ΔH=ΔH1+ΔH2 ④大气层中的臭氧无法再生
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:简答题
(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色(用相应的元素符号完成下列空白)
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。
(2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
已知锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似。下列有关锂及其化合物叙述正确的是( )
A.Li2SO4难溶于水 B.Li与N2反应产物是Li3N
C.LiOH易溶于水 D.LiOH与Li2CO3受热都很难分解
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
下列电子式书写正确的是 ( )
A.氮气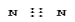 B.二氧化碳
B.二氧化碳
C.水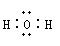 D.氯化铵
D.氯化铵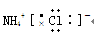
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A.4KI+O2+2H2O=4KOH+2I2
B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca
C.I2+2NaClO3=2NaIO3+Cl2
D.MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com